
| A. | 标准状况下,2.24LCHCl3的分子数0.1NA | |
| B. | 用惰性电极电解1 L浓度均为2 mol•L-1的AgNO3与Cu(NO3)2的混合溶液,当有0.2 NA个电子转移时,理论上阴极析出6.35g金属 | |
| C. | 9.2gNO2和N2O4的混合气中含有的氮原子数为大于0.2NA | |
| D. | VL a mol•L-1的氯化铁溶液中,若Fe3+的数目为NA,则Cl-的数目大于3NA |
分析 A、标况下,三氯甲烷为液态;
B、根据阳离子的放电顺序判断;
C、NO2和N2O4的最简式为NO2;
D、氯化铁溶液中,铁离子部分水解,铁离子数目减少,所以铝离子数目大于铁离子数目的3倍.
解答 解:A、标况下,三氯甲烷为液态,不能根据气体摩尔体积来计算,故A错误;
B、Ag+氧化性大于Cu2+,1L浓度均为2mol/L的AgNO3与Cu(NO3)2的混合溶液,当有0.2mol电子转移时,首先析出Ag,质量为0.2mol×108g/mol=21.6g,故C错误;
C、NO2和N2O4的最简式为NO2,故9.2g混合气体中含有的NO2的物质的量n=$\frac{9.2g}{46g/mol}$=0.2mol,故含有的额氮原子的个数为0.2NA个,故C错误;
D、V L 0.1mol/L的氯化铁溶液中,铁离子部分水解,溶液中铁离子数目减少,若Fe3+的数目为NA,则Cl-的数目大于3NA,故D正确;
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案科目:高中化学 来源: 题型:选择题
| A. | 温度不变,缩小体积,CIF的转化率增大 | |
| B. | 温度不变,增大体积,CIF3的产率提高 | |
| C. | 升高温度,增大体积,有利于平衡向正反应方向移动 | |
| D. | 降低温度,体积不变,F2的转化率降低 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 增大压强 | B. | 通入氦气 | C. | 增加Y的物质的量 | D. | 升高温度 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 温度 | B. | 压强 | C. | 浓度 | D. | 加催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 全部 | B. | 只有①③⑤ | C. | 只有②④⑥ | D. | 只有①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用润湿的pH试纸测稀酸溶液的pH,测定值偏大 | |
| B. | 用容量瓶配制溶液,定容时俯视刻度线,所配溶液浓度偏小 | |
| C. | 用标准酸液滴定未知碱液时,若酸式滴定管未润洗,则测定结果偏大 | |
| D. | 测定中和反应的反应热时,将碱缓慢倒入酸中,所测结果偏低 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
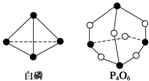 化学键的键能是形成(或断开)1mol化学键时释放(或吸收)的能量.已知白磷和P4O6的分子结构如图所示,现提供以下化学键的键能(kJ•mol-1):P-P:198 P-O:360 O═O:498若生成1mol P4O6,则反应P4(白磷)+3O2═P4O6中的能量变化为( )
化学键的键能是形成(或断开)1mol化学键时释放(或吸收)的能量.已知白磷和P4O6的分子结构如图所示,现提供以下化学键的键能(kJ•mol-1):P-P:198 P-O:360 O═O:498若生成1mol P4O6,则反应P4(白磷)+3O2═P4O6中的能量变化为( )| A. | 吸收1 638 kJ能量 | B. | 放出1 638 kJ能量 | ||
| C. | 吸收126 kJ能量 | D. | 放出126 kJ能量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com