



 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
 将一个装有饱和石灰水的试管放入盛有25℃饱和石灰水的广口瓶中,如图所示.
将一个装有饱和石灰水的试管放入盛有25℃饱和石灰水的广口瓶中,如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、3.2 g不溶物为铁、铜混合物 |
| B、加铁粉之前,溶液中存在的金属阳离子有Cu2+、Fe3+ |
| C、加铁粉之前,溶液中的c(Cu2+):c(Fe2+)=1:1 |
| D、反应结束后溶液中的c(Fe2+)=2 mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、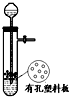 用于Cu和浓H2SO4反应制取少量的SO2气体 |
B、 用于灼烧Al(OH)3 |
C、 用于检验浓硫酸与蔗糖反应产生的二氧化硫 |
D、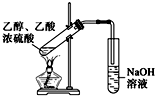 由于实验室制备乙酸乙酯 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、25℃时,Mg(OH)2固体在氨水中的Ksp比在NH4Cl溶液中的Ksp小 |
| B、25℃时,向Mg(OH)2的澄清饱和溶液中加入少量NH4Cl固体,c(Mg2+)减小 |
| C、25℃时,Mg(OH)2的溶解能力大于MgF2的溶解能力 |
| D、25℃时,饱和Mg(OH)2溶液与0.1mol?L-1NaF溶液等体积混合,能生成MgF2沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 规律 | 结论 |
| A | 较强酸可以制取较弱酸 | 用亚硫酸溶液无法制取硫酸溶液 |
| B | 升高温度,反应速率越快 | 常温下钠与氧气反应生成氧化钠,升高温度,Na2O的生成速率加快 |
| C | 金属越活泼,其阳离子氧化性越弱 | Fe3+的氧化性弱于Cu2+ |
| D | Ksp小的沉淀易向Ksp更小的沉淀转化 | CaSO4悬浊液中滴加Na2CO3溶液可生成CaCO3沉淀 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、中性溶液:Cu2+、Al3+、NO3-、SO42- |
| B、加入苯酚显紫色的溶液:K+、NH4+、Cl-、NO3- |
| C、加入Al能放出大量H2的溶液中:NH4+、Fe2+、NO3-、SO42- |
| D、常温下,c(H+)/c(OH-)=1×1012的溶液:K+、AlO2-、CO32-、Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com