
【题目】浓度均为0.1mol·L-1的①H2S、②NaHS、③Na2S、④H2S和NaHS混合液,溶液pH从大到小的顺序是____。
A.④>③>②>①B.②>③>①>④C.④>①>②>③D.③>②>④>①
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】根据题意填空
(1)现有甲、乙、丙三名同学分别进行Fe(OH)3胶体的制备实验.甲同学:向1molL﹣1的FeCl3溶液中加少量NaOH溶液.乙同学:直接加热饱和FeCl3溶液.丙同学:向25mL沸水中逐滴加入5~6滴FeCl3饱和溶液;继续煮沸至溶液呈红褐色,停止加热.
试回答下列问题:
a.其中操作正确的同学是 .
b.证明有Fe(OH)3胶体生成的实验操作是 .
c.已知同种胶体微粒带有同种电荷,丁同学将所制得的Fe(OH)3胶体装入U形管内,用石墨作电极,通电一段时间后发现阴极区附近的颜色逐渐变深,这表明Fe(OH)3胶体微粒带(带“正”或“负”)电荷.
(2)某学生欲用98% (ρ=1.84g/cm3)的硫酸配制6.0mol/L的H2SO4溶液950mL,请回答下列问题:
d.实验所用98%的硫酸的物质的量浓度为mol/L.
e.该实验需要使用到的玻璃仪器有:量筒、烧杯、玻璃棒、胶头滴管、 .
f.若配制操作定容时,眼睛俯视,则所配制的溶液浓度将(偏大、偏小,无影响?)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实中,能用勒夏特列原理解释的是
A. 对CO(g)+NO2(g)![]() CO2(g) + NO(g)平衡体系增大压强可使顔色变深
CO2(g) + NO(g)平衡体系增大压强可使顔色变深
B. 对2SO2+O2![]() 2SO3 △H<0的反应,使用催化剂可加快反应的速率
2SO3 △H<0的反应,使用催化剂可加快反应的速率
C. 实验室可用浓氨水和氢氧化钠固体快速制取氨气
D. N2(g)+3H2(g)![]() 2NH3(g) △H<0,500℃左右比室温更有利于合成NH3
2NH3(g) △H<0,500℃左右比室温更有利于合成NH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化学反应与能量的说法正确的是
A.酸碱中和是放热反应
B.炭在氧气中燃烧属于吸热反应
C.化学键的形成需吸收能量
D.化学反应过程中,化学能一定转化成热能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 增大压强或升高温度,—定能使化学反应速率加快
B. 己知 Ni(CO)4(g)=Ni(s)+4CO(g) △H=QkJ/mol,则 Ni(s) +4CO(g)=Ni(CO)4(g) △H=-QkJ/mol
C. 500°C、30 MPa下, 0.5 mol N2(g)和1.5mol H2(g)反应生成NH3(g) 放热QkJ,其热化学方程式为N2(g)+3 H2(g)![]() 2 NH3(g) △H=-2QkJ/mol
2 NH3(g) △H=-2QkJ/mol
D. 己知两个平衡体系:2NiO(s)![]() 2Ni(s)+O2(g) 2CO(g)+O2(g)
2Ni(s)+O2(g) 2CO(g)+O2(g)![]() 2CO2(g)是平衡常数分别为K1和K2,可推知平衡NiO(s)+CO(g)
2CO2(g)是平衡常数分别为K1和K2,可推知平衡NiO(s)+CO(g)![]() Ni(s)+CO2(g)的平衡常数为
Ni(s)+CO2(g)的平衡常数为![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.二氧化碳的相对分子质量是44 B.“物质的量浓度”可简称为“量浓度”
C.阿伏加德罗常数的单位是mol-1 D.1 mol任何物质所占体积都是22.4 L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用铅蓄电池电解甲、乙电解图池中的溶液。已知铅蓄电池的总反应为Pb(s)+PbO2(s)+2H2SO4(aq) ![]() 2PbSO4(s)+2H2O(l)。电解一段时间后,发现a极上析出红色固体物质,下列说法正确的是( )
2PbSO4(s)+2H2O(l)。电解一段时间后,发现a极上析出红色固体物质,下列说法正确的是( )
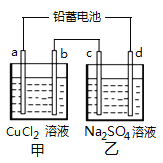
A. d极为阴极
B. 若利用甲池精炼铜,b极应为粗铜
C. 放电时铅蓄电池负极的电极反应式为:
PbO2(s)+4H+(aq)+SO![]() (aq)+2e- =PbSO4(s)+2H2O(l)
(aq)+2e- =PbSO4(s)+2H2O(l)
D. 若四个电极材料均为石墨,当析出6.4 g Cu时,两池中共产生气体3.36 L(标准状况下)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com