
| 应量取浓盐酸体积/mL | 应选用容量瓶的规格/mL |
分析 (1)根据c=$\frac{1000ρω}{M}$计算该盐酸的物质的量浓度;
(2)依据溶液稀释规律:稀释前后含的溶质的物质的量不变计算需要浓溶液的体积,依据配制溶液体积选择容量瓶规格;
(3)依据配制一定物质的量浓度溶液的一般步骤排序解答;
(4)烧杯和玻璃棒上都沾有硫酸,洗涤液中含有少量的溶质,为避免溶质的量的减少,应将洗涤液全部转移到容量瓶中;
(5)凡是导致实验失败的操作且不能补救的都必须重新配制溶液;
(6)分析操作对溶质的物质的量和溶液体积的影响,依据C=$\frac{n}{V}$进行判断.
解答 解:(1)密度为1.25g•mL-1,溶质质量分数为36.5%的浓盐酸的物质的量浓度C=$\frac{1000×1.25×36.5%}{36.5}$=12.5mol/L;
故答案为:12.5mol/L;
(2)配制240mL 0.1mol•L-1的盐酸,应选择250mL容量瓶,设需要浓盐酸体积为V,则依据溶液稀释规律:稀释前后含的溶质的物质的量不变,V×12.5mol/L=250mL×0.1mol/L,解得V=2.0mL;
故答案为:2.0;250;
(3)配制一定物质的量浓度溶液的一般步骤:计算、量取、稀释、冷却、移液、洗涤、定容、摇匀、装瓶,所以正确顺序为:BCAFED;
B.量取2.0mL盐酸,需要用5mL量筒;
E、F.定容时,继续往容量瓶内小心加水,直到液面接近刻度线1-2cm处,改用胶头滴管加水,使溶液凹液面最低处恰好与刻度线相切;
故答案为:BCAFED;5mL;胶头滴管;1-2cm;
(4)烧杯和玻璃棒上都沾有硫酸,洗涤液中含有少量的溶质,为避免溶质的量的减少,应将洗涤液全部转移到容量瓶中.
故答案为:洗涤液中含有少量的溶质,为避免溶质的量的减少,应将洗涤液全部转移到容量瓶中;
(5)①加蒸馏水时不慎超过了刻度线,实验失败且不能补救,必须重新配制;
②向容量瓶中转移溶液时不慎有液滴溅在容量瓶外面,实验失败且不能补救,必须重新配制;
故答案为:重新配制;重新配制;
(6)A.定容时仰视刻度线,导致溶液体积偏大,溶液浓度偏低;
B.忘记将洗涤液加入容量瓶,导致溶质的物质的量偏小,溶液浓度偏低;
C.容量瓶内壁附有水珠而未干燥处理,对溶质的物质的量和溶液的体积都不会产生影响,溶液浓度不变;
D.溶解后没有冷却便进行定容,冷却后,溶液体积偏小,溶液浓偏高;
故答案为:偏低;偏低;不变;偏高.
点评 本题考查了一定物质的量浓度溶液的配制,明确配置原理和操作步骤是解题关键,注意误差分析的方法和技巧.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  | B. |  | ||
| C. |  | D. |  |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 阳离子 | K+ Na+ Cu2+ Al3+ |
| 阴离子 | SO42- HCO3- NO3- OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.43g/L | B. | 1.90g/L | C. | 2.14g/L | D. | 2.38g/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
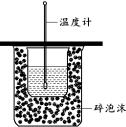 下列实验操作正确的是( )
下列实验操作正确的是( )| A. | 用图装置测定中和热 | |
| B. | 将同浓度的FeCl3溶液和CuSO4溶液分别滴入H2O2中,滴入FeCl3溶液的H2O2更快产生气泡.不能得出结论对H2O2分解的催化效果Fe3+>Cu2+ | |
| C. | 研究H+浓度对该平衡:Cr2O72-+H2?2CrO42-+2H+的影响,往5mL 0.1mol/L K2CrO4溶液加入5mL 0.1mol/L的稀硫酸 | |
| D. | 测定溶液的pH值时,用玻璃棒蘸取少量溶液点在湿润的pH试纸上再与标准比色卡对照 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同物质的量浓度的三种溶液的pH:a=b>c | |
| B. | 同pH时,三种溶液稀释相同倍数后,pH:a=b<c | |
| C. | 同pH、同体积的三种溶液消耗同浓度盐酸的体积:a=b=c | |
| D. | 同pH时,稀释不同倍数、pH仍相同,三种溶液稀释的倍数:a>b>c |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com