
【题目】在2 L的密闭容器中,发生以下反应:2A(g)+B(g) ![]() 2C(g)+D(g),若最初加入的A和B都是4 mol,在前10 s A的平均反应速率为0.12 mol/(L·s),则10 s时,容器中B的物质的量是( )
2C(g)+D(g),若最初加入的A和B都是4 mol,在前10 s A的平均反应速率为0.12 mol/(L·s),则10 s时,容器中B的物质的量是( )
A.3.4 molB.3.2 molC.2.8 molD.1.2 mol
科目:高中化学 来源: 题型:
【题目】某原电池的装置如图所示,总反应为 H2(g)+HgO(s)=H2O(1)+Hg(1),其中阴离子交换膜只允许阴离子和水分子通过。下列说法正确的是( )
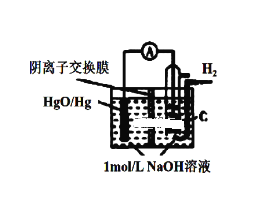
A.正极反应为:HgO(s)2e+H2O=Hg(l)+2OH
B.OH-通过离子交换膜从负极向正极移动,保持溶液中电荷平衡
C.每反应2.24L氢气,交换膜通过0.2mol离子
D.放电结束后,溶液的碱性减弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数,下列叙述正确的是
A.常温常压下,1.06g Na2CO3含有的Na+离子数目为0.02 NA
B.常温常压下,2NA个CO2分子占有的体积为44.8L
C.标准状况下,22.4LH2O含有的分子数为 NA
D.物质的量浓度为0.5mol/L的MgCl2溶液中,含有Cl-个数为 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】3 mol A和2.5 mol B混合于2 L密闭容器中,发生的反应如下:3A(g)+B(g) ![]() xC(g)+2D(g),5 min后反应达到平衡,容器内压强变小,测得D的平均反应速率为0.1 mol/(L·min),下列结论正确的是
xC(g)+2D(g),5 min后反应达到平衡,容器内压强变小,测得D的平均反应速率为0.1 mol/(L·min),下列结论正确的是
A. A的平均反应速率为 0.1 mol/(L·min)
B. 平衡时,C的浓度为 0.125 mol/L
C. 平衡时,B的转化率为 20%
D. 平衡时,容器内压强为原来的 0.8 倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应:![]() 在恒温恒容密闭容器中反应,达到平衡状态的标志是
在恒温恒容密闭容器中反应,达到平衡状态的标志是
![]() 单位时间内生成n
单位时间内生成n![]() 的同时消耗2n
的同时消耗2n![]() ;
;
![]() 单位时间内生成n
单位时间内生成n![]() 的同时消耗2nmolNO;
的同时消耗2nmolNO;
![]() 混合气体的颜色不再改变的状态;
混合气体的颜色不再改变的状态;
![]() 混合气体中
混合气体中![]() 不变;
不变;
![]() 的消耗速率与NO的生成速率相等;
的消耗速率与NO的生成速率相等;
![]() 容器内压强不随时间变化而变化。
容器内压强不随时间变化而变化。
A. ![]() B.
B. ![]() C.
C. ![]() D.
D. ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用惰性电极电解1.0 L c(Cl-)=3.0 mol/L的CuCl2、NaCl混合溶液,一段时间后,两极均收集到56.0 L的气体(标准状况下)。下列说法正确的是( )
A.阳极只收集到Cl2
B.电解前溶液呈弱酸性,电解结束后,溶液的酸性增强
C.整个过程中共转移电子5 mol
D.原混合溶液中c(Cu2+)=1.0 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车等机动车尾气,含(CO、NO等)是城市空气的污染源。利用NSR技术可有效降低CO、NO的排放,回答有关问题:
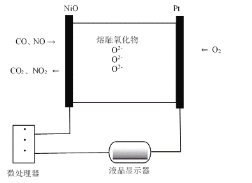
I.CO、NO的检测
(1)O2-的移动方向为__________。(填“向Pt电极”或“向NiO电极”)
(2)NiO电极上的电极反应为___________和__________。
II.NSR处理技术
NO的储存和还原在不同时段交替进行,实现两种有害气体,同时被处理,工作如图所示。
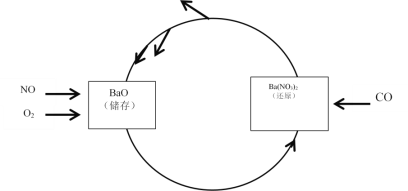
(3)已知:N2(g)+O2(g)=2NO(g) ΔH=+180.5 kJ/mol ①
2CO(g)+O2(g)=2CO2(g) ΔH=-566.0 kJ/mol ②
则NSR技术工作原理的热化学方程式:2CO(g)+2NO(g)=N2(g)+2CO2(g)③的ΔH=________
(4)在一定温度下,向2L恒容密闭容器中充入等物质的量的NO和CO,发生反应,反应过程中c(NO)随时间的变化曲线如图所示。
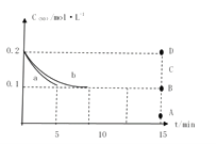
①图中曲线a或b中表示在该温度下使用NSR催化技术的是__________。
②曲线b中前10min内CO的平均反应速率v(CO)=_________;此温度下该反应的平衡常数K为_______。若平衡后,再向容器中充入CO和N2各0.8mol,则此时v(正)_____ v(逆)(填“>”、“<”或“=”)。
③若保持其他条件不变,15min时将容器的体积压缩至1L,20min时反应重新达到平衡,NO的物质的量浓度对应的点可能是____点。(填字母)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaBiO3可作为钢铁分析中测定锰的氧化剂,Bi2O3在电子行业有着广泛应用,可利用浮选过的辉铋矿(主要成分是Bi2S3,还含少量SiO2等杂质)来制备。其工艺流程如下:
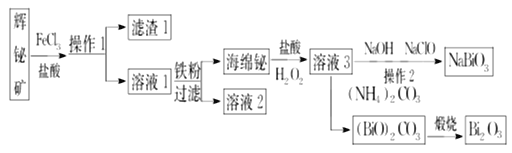
回答下列问题:
(1)辉铋矿的“浸出液”中铋元素主要以Bi3+形式存在,写出Bi2S3与FeCl3溶液反应的离子方程式:______,滤渣1的主要成分是__________(填化学式)和硫。
(2)NaBiO3是为数不多的钠盐沉淀之一,由溶液3制得纯净的NaBiO3,操作2包括_____________。
(3)Bi2O3与Na2O2可在熔融状态下反应制得NaBiO3,其副产物的化学式为________________。
(4)写出“煅烧”中由碱式碳酸铋[(BiO)2CO3]制备Bi2O3的化学方程式: ____________。
(5)某工厂用m1 kg辉铋矿(含Bi2S3 60%)制备NaBiO3,最终得到产品m2 kg,产率为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A.分子式为C15H16O2的部分同分异体中可能含有联苯结构单元
B.1.0 mol的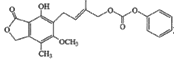 最多能与含5.0 mol NaOH的水溶液完全反应
最多能与含5.0 mol NaOH的水溶液完全反应
C.乳酸薄荷醇醋(![]() )能发生水解、氧化、消去反应
)能发生水解、氧化、消去反应
D.CH3COOCH2CH3与CH3CH2COOCH3互为同分异构体,1H-NMR谱显示两者均有三种不同的氢原子且三种氢原子的比例相同,故不能用1H-NMR来鉴别
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com