
【题目】碳是形成化合物种类最多的元素,其单质及化合物是人类生产生活的主要能源物质。请回答下列问题:
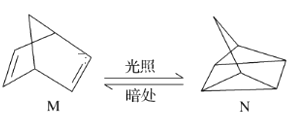
(1)有机物M经过太阳光光照可转化成N,转化过程如下,ΔH=+88.6 kJ·mol-1。则M、N相比,较稳定的是________。
(2)已知CH3OH(l)的燃烧热ΔH=-726.5 kJ·mol-1,CH3OH(l)+![]() O2(g)=CO2(g)+2H2(g) ΔH=-a kJ·mol-1则a________726.5(填“>”“<”或“=”)
O2(g)=CO2(g)+2H2(g) ΔH=-a kJ·mol-1则a________726.5(填“>”“<”或“=”)
(3)将Cl2和H2O(g)通过灼热的炭层,生成HCl和CO2,当有1 mol Cl2参与反应时释放出145.0 kJ热量,写出该反应的热化学方程式:________________________________________。
(4)火箭和导弹表面的薄层是耐高温物质。将石墨、铝粉和二氧化钛按一定比例混合在高温下煅烧,所得物质可作耐高温材料:4Al(s)+3TiO2(s)+3C(s)===2Al2O3(s)+3TiC(s) ΔH=-1 176.0 kJ·mol-1,则反应过程中,每转移1 mol电子放出的热量为_______。
(5) 已知:①C(s)+O2(g)===CO2(g) ΔH1=-393.5 kJ·mol-1
②2CO(g)+O2(g)===2CO2(g) ΔH2=-566 kJ·mol-1
③TiO2(s)+2Cl2(g)===TiCl4(s)+O2(g) ΔH3=+141 kJ·mol-1
则TiO2(s)+2Cl2(g)+2C(s)===TiCl4(s)+2CO(g)的 ΔH=__________________。
(6)已知拆开1 mol H—H键,1 mol N—H键,1mol N≡N键分别需要的能量是436 kJ、391 kJ、946 kJ,则N2(g)与H2(g)反应生成NH3(g)的热化学方程式为:________________。
【答案】M < 2Cl2(g)+2H2O(g)+C(s)=4HCl(g)+CO2(g) ΔH=-290.0 kJ·mol-1 98.0 kJ —80 kJ·mol-1 N2(g)+3H2(g) ![]() 2NH3(g) ΔH=-92.0 kJ·mol-1
2NH3(g) ΔH=-92.0 kJ·mol-1
【解析】
(1)M转化为N是吸热反应,所以N的能量高,不稳定;
(2)甲醇燃烧生成CO2(g)和H2(g)属于不完全燃烧,放出的热量少,故a<238.6;
(3)有1mol Cl2参与反应时释放出145kJ热量,2mol氯气反应放热290kJ,注物质聚集状态和对应反应焓变写出热化学方程式;
(4)所给反应中转移12个电子,故每转移1mol电子放出的热量为![]() =98kJ;
=98kJ;
(5)先根据反应物和生成物书写化学方程式,根据盖斯定律计算反应的焓变,最后根据热化学方程式的书写方法来书写热化学方程式;
(6)化学反应中,化学键断裂吸收能量,形成新化学键放出能量,根据方程式计算分别吸收和放出的能量,以此计算反应热并判断吸热还是放热。
(1)有机物M经过太阳光光照可转化为N的关系是吸收能量,则N能量高,比M活泼,较稳定的化合物为M;
(2)甲醇燃烧生成CO2(g)和H2(g)属于不完全燃烧,放出的热量少,所以a<726.5,故答案为:<;
(3)有1mol Cl2参与反应时释放出145kJ热量,2mol氯气反应放热290kJ,反应的热化学方程式为:2Cl2(g)+2H2O(g)+C(s)═4HCl(g)+CO2(g)△H=-290kJmol-1 ;
(4)4Al(s)+3TiO2(s)+3C(s)═2Al2O3(s)+3TiC(s)△H=-1176kJmol-1,转移12mol电子放热1176kJ,则反应过程中,每转移1mol电子放热98.0 kJ;
(5)已知:①C(s)+O2(g)=CO2(g) ΔH1=-393.5 kJ·mol-1
②2CO(g)+O2(g)=2CO2(g) ΔH2=-566 kJ·mol-1
③TiO2(s)+2Cl2(g)=TiCl4(s)+O2(g) ΔH3=+141 kJ·mol-1
根据盖斯定律,由①![]() 2-②+③得反应TiO2(s)+2Cl2(g)+2C(s)=TiCl4(s)+2CO(g)的 ΔH=ΔH1
2-②+③得反应TiO2(s)+2Cl2(g)+2C(s)=TiCl4(s)+2CO(g)的 ΔH=ΔH1![]() 2-ΔH2+ΔH3=—80 kJ·mol-1;
2-ΔH2+ΔH3=—80 kJ·mol-1;
(6)在反应N2+3H22NH3中,断裂3molH-H键,1mol N三N键共吸收的能量为:3×436kJ+946kJ=2254kJ,生成2mol NH3,共形成6mol N-H键,放出的能量为:6×391kJ=2346kJ,吸收的热量少,放出的热量多,该反应为放热反应,放出的热量为:2346kJ-2254kJ=92kJ,则N2(g)与H2(g)反应生成NH3(g)的热化学方程式为: N2(g)+3H2(g) ![]() 2NH3(g) ΔH=-92.0 kJ·mol-1。
2NH3(g) ΔH=-92.0 kJ·mol-1。


科目:高中化学 来源: 题型:
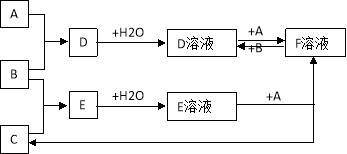
【题目】已知A、B、C为中学化学中常见的单质, A为是生产、生活中用量最大、用途最广的金属单质,室温下B是黄绿色气体,C为无色气体。在一定条件下相互转化的关系如图所示。
请回答以下问题:
(1)A、B、C分别是什么物质:A是 ,B是 ,C是,F是 (填化学式)
(2)写出A和B生成D的化学方程式: ,向D溶液中加
入 溶液可看到溶液变血红色。
(3)写出F溶液中加入B的离子方程式:
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下述转化关系,回答问题:

已知:①+CH3Br![]() CH3+HBr;
CH3+HBr;
②C物质苯环上一卤代物只有两种。
(1)写出B物质的名称__________;D物质的结构简式________。
(2)写出反应②的类型________;反应⑤的条件________。
(3)写出反应⑥的化学方程式:________________________________。
(4)写出D+E反应的化学方程式:_______________。
(5)反应②还有可能生成一种C16H18的有机物,其苯环上一卤代物也只有两种,写出它的结构简式:_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种基于锂元素的电化学过程来合成氨的方法,其效率能达到88.5%。其工艺流程如图所示,下列说法错误的是( )
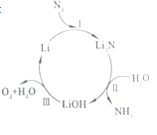
A.反应Ⅰ的关键是隔绝空气和水
B.反应Ⅱ的产物LiOH是离子化合物
C.整个流程中,金属锂是催化剂
D.整个流程的总化学方程式为:2N2+6H2O═4NH3+3O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:I2+2S2O32-=S4O62-+2I-;CuI是不溶于水的白色沉淀。
相关物质的溶度积常数见下表:
物质 | Cu(OH)2 | Fe(OH)3 | CuCl | CuI |
Ksp | 2.2×10-20 | 2.6×10-39 | 1.7×10-7 | 1.3×10-12 |
(1)某酸性CuCl2溶液中含有少量的FeCl3,为得到纯净的CuCl2·2H2O晶体,加入_________,调至pH=4,使溶液中的Fe3+转化为Fe(OH)3沉淀,此时溶液中的c(Fe3+)=_________。过滤后,将所得滤液低温蒸发、浓缩结晶,可得CuCl2·2H2O晶体。
(2)在空气中直接加热CuCl2·2H2O晶体得不到纯的无水CuCl2,原因是(用文字叙述):____________________________________________。由CuCl2·2H2O晶体得到纯的无水CuCl2的合理方法是______________________________。
(3)某学习小组用“间接碘量法”测定含有CuCl2·2H2O晶体的试样(不含能与I-发生反应的氧化性杂质)的纯度,过程如下:取0.36 g试样溶于水,加入过量KI固体,充分反应,生成白色沉淀。用0.100 0 mol·L-1 Na2S2O3标准溶液滴定,到达滴定终点时,消耗Na2S2O3标准溶液20.00 mL。
①可选用_______________作滴定指示剂,滴定终点的现象是________________________。
②CuCl2溶液与KI反应的离子方程式为___________________________________________。
③该试样中CuCl2·2H2O的质量百分数为__________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组探究SO2气体的性质,装置如图所示,下列说法不合理的是( )
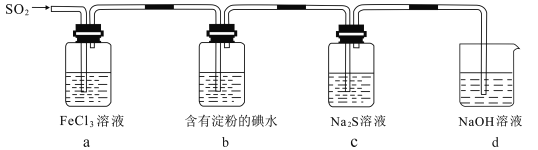
A.a装置中FeCl3溶液逐渐变为浅绿色,说明SO2有还原性
B.c装置Na2S溶液中出现浅黄色浑浊,说明SO2具有氧化性
C.b装置中蓝色退去,说明还原性:SO2> I-
D.b、c装置中发生反应转移的电子数一定相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物X是重要的有机化工原料,Y是一种功能高分子材料,下面为各物质之间的转化关系(部分产物、合成路线、反应条件略去)。
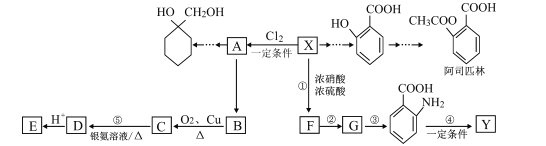
已知:①X为芳香烃,其相对分子质量为92;
②烷基苯在高锰酸钾的作用下,侧链被氧化成羧基![]() ;
;
③![]() (苯胺,易被氧化)
(苯胺,易被氧化)
请根据本题所给信息与所学知识回答下列问题:
(1)E的分子式为___,反应②的反应类型是___。
(2)1mol阿司匹林最多能与___mol氢氧化钠溶液反应。
(3)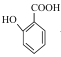 与少量碳酸氢钠反应的化学方程式___。
与少量碳酸氢钠反应的化学方程式___。
(4)反应④的化学方程式为___。
(5)比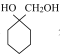 少一个碳原子的有机物(分子式为C6H12O2)有多种同分异构体,其中同时符合下列条件的有___种。
少一个碳原子的有机物(分子式为C6H12O2)有多种同分异构体,其中同时符合下列条件的有___种。
①能与金属钠反应 ②含两个甲基 ③能发生银镜反应;
其中核磁共振氢谱为6:2:2:1:1的有机物结构简式为___ (只写任意一种)。
(6)参照上述合成路线,结合所学知识,写出以A为原料制备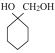 的合成路线___。
的合成路线___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】双酚A( )是一种重要的化工原料,它的一种合成路线如下图所示:
)是一种重要的化工原料,它的一种合成路线如下图所示:
丙烯![]()
![]()
![]()
![]()
![]()
![]()
![]() 双酚A
双酚A
下列说法正确的是( )
A. 1 mol 双酚A最多可与2 mol Br2反应
B. G物质是乙醛的同系物
C. E物质的名称是1-溴丙烷
D. 反应③的化学方程式是![]() +O2
+O2![]() 2CH3COCH3+2H2O
2CH3COCH3+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)某烷烃相对相对分子量为72,该烃的化学式是 ______ ,它有 ______ 种同分异构体,其中沸点最高的是 ______ (填结构简式)其核磁共振氢谱中只有一种峰,则它的结构简式为 ______
(2)分子式为C8H10有多种同分异构体,其中属于芳香烃,且苯环上的一氯取代物只有一种,请写出该芳香烃的结构简式________。
(3)按要求写出下列化学方程式:
①制取乙炔的化学方程式:______
②丙烯→聚丙烯______;
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com