
| A. | 1:3 | B. | 9:8 | C. | 3:4 | D. | 4:3 |
分析 把铝粉和Fe3O4粉末混合物,分成两等份,一份在高温下恰好完全反应生成铁与氧化铝,由电子转移守恒可知$\frac{8}{3}$n(Fe)=3n(Al),然后将生成物与足量的稀盐酸反应,铁与盐酸反应生成氯化亚铁与氢气,由电子转移守恒可知n(H2)=n(Fe);令一份直接加入足量的NaOH溶液使之充分反应,铝与氢氧化钠反应生成偏铝酸钠与氢气,由电子转移守恒可知2n′(H2)=3n(Al),据此计算判断.
解答 解:把铝粉和Fe3O4粉末混合物,分成两等份,一份在高温下恰好完全反应生成铁与氧化铝,由电子转移守恒可知$\frac{8}{3}$n(Fe)=3n(Al),然后将生成物与足量的稀盐酸反应,铁与盐酸反应生成氯化亚铁与氢气,由电子转移守恒可知n(H2)=n(Fe),所以n(H2)=$\frac{9}{8}$n(Al);
令一份直接加入足量的NaOH溶液使之充分反应,铝与氢氧化钠反应生成偏铝酸钠与氢气,由电子转移守恒可知2n′(H2)=3n(Al),所以n′(H2)=$\frac{3}{2}$n(Al).
故两种情况下生成气体的物质的量之比为n(H2):n′(H2)=$\frac{9}{8}$n(Al):$\frac{3}{2}$n(Al)=3:4,
故选:C.
点评 本题考查混合物的计算、根据方程式的计算,难度中等,清楚反应过程是关键,注意利用电子转移守恒解答.


 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案科目:高中化学 来源: 题型:选择题
| 序列 | 参加反应的物质 | 生成物 |
| ① | MnO4- … | Cl2、Mn2+ … |
| ② | Cl2、FeBr2 | FeCl3、FeBr3 |
| ③ | KMnO4、H2O2、H2SO4 | K2SO4、MnSO4 … |
| A. | 第①组反应中生成0.5mol Cl2,转移电子1mol | |
| B. | 第②组反应中Cl2与 FeBr2的物质的量之比为1:2 | |
| C. | 第③组反应的其余产物为H2O和 O2 | |
| D. | 氧化性由强到弱顺序为MnO4->Cl2>Fe3+>Br2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
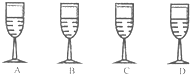 在班级的“元旦晚会”中,小明表演魔术:在桌面上摆4个盛无色液体的高脚杯,他将A高脚杯液体分别倒入其他三个中,看到下列现象:B中液体产生大量气泡变为汽水;C中液体变为红色葡萄酒;D中液体变为“牛奶”(产生大量白色沉淀).
在班级的“元旦晚会”中,小明表演魔术:在桌面上摆4个盛无色液体的高脚杯,他将A高脚杯液体分别倒入其他三个中,看到下列现象:B中液体产生大量气泡变为汽水;C中液体变为红色葡萄酒;D中液体变为“牛奶”(产生大量白色沉淀).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化合物:CaCl2、烧碱、聚乙烯、HD | |
| B. | 酸性氧化物:SO2、NO、CO2、Mn2O7 | |
| C. | 胶体:雾、牛奶、豆浆、烟水晶 | |
| D. | 同系物:CH2O2、C2H4O2、C3H6O2、C4H8O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将3molNH4NO3溶于一定浓度的稀氨水中,溶液呈中性,溶液中一定含有3NA个NH4+ | |
| B. | 标准状况下,含有1mol硫原子的SO2与SO3的混合物,其体积小于22.4L | |
| C. | 10g质量分数为46%的乙醇水溶液中,氢原子的总数为1.2NA | |
| D. | 1L 1mol•L-1的碳酸钠溶液中钠离子的数目小于2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸铜溶液与氢氧化钡溶液反应:Ba2++SO42-═BaSO4↓ | |
| B. | 氯化铝溶液中加入过量的氨水:Al3++3NH3•H2O═Al(OH)3↓+3NH4+ | |
| C. | 硫酸亚铁溶液中通入足量的氯气:Fe2++Cl2═Fe3++2Cl- | |
| D. | 石灰石溶于醋酸:CaCO3+2H+═Ca2++CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 实验步骤 | 预期现象和结论 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 序号 | ① | ② |
| PH | 12 | 12 |
| 溶液 | 氨水 | 氢氧化钠溶液 |
| A. | 与AlCl3溶液发生反应的离子方程式均为Al3++3OH-═Al(OH)3↓ | |
| B. | ①溶液的物质的量浓度为0.01mol•L-1 | |
| C. | ①②两溶液分别加水稀释10倍,稀释后溶液的pH:①>② | |
| D. | 等体积的①②两溶液分别与0.01mol•L-1的盐酸完全中和,消耗盐酸的体积:①>② |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
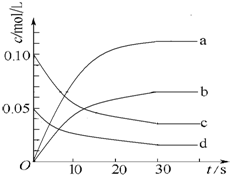 在2L密闭容器内,800℃时反应2NO(g)+O2(g)?2NO2(g)△H<0体系中,n(NO)随时间的变化如下表:
在2L密闭容器内,800℃时反应2NO(g)+O2(g)?2NO2(g)△H<0体系中,n(NO)随时间的变化如下表:| 时间/s | 0 | 10 | 20 | 30 | 40 | 50 |
| n(NO)/mol | 0.20 | 0.10 | 0.08 | 0.07 | 0.07 | 0.07 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com