
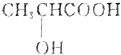 )有一对手性异构体,因为其分子中含有一个手性碳原子.
)有一对手性异构体,因为其分子中含有一个手性碳原子.| A. | 1句 | B. | 2句 | C. | 3句 | D. | 4句 |
分析 ①分子晶体熔化时一般破坏分子间作用力,而不影响化学键;
②根据相似相溶原理判断;
③NaCl晶胞结构为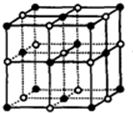 ,晶体中与每个Na+距离相等且最近的Na+个数=3×8÷2;
,晶体中与每个Na+距离相等且最近的Na+个数=3×8÷2;
④稀有气体不存在化学键;
⑤元素的非金属性越强,其氢化物越稳定,氢化物的还原性越弱;
⑥结构相似的分子晶体,相对分子质量越大,沸点越高;
⑦金属Mg是六方最密堆积,配位数为12;CsCl晶体中阴阳离子配位数是8;
⑧ 中间碳原子上连有四个不一样的基团:氢原子、甲基、羧基和羟基,是手性碳原子.
中间碳原子上连有四个不一样的基团:氢原子、甲基、羧基和羟基,是手性碳原子.
解答 解:①分子晶体熔化时一般破坏分子间作用力,而不影响化学键,如冰融化形成水,化学键没有被破坏,故错误;
②卤化氢属于极性分子,易溶于极性溶剂水,不易溶于非极性溶剂四氯化碳,故正确;
③NaCl晶胞结构为 ,晶体中与每个Na+距离相等且最近的Na+个数=3×8÷2=12,所以NaCl晶体中与每个Na+距离相等且最近的Na共有12个故错误;
,晶体中与每个Na+距离相等且最近的Na+个数=3×8÷2=12,所以NaCl晶体中与每个Na+距离相等且最近的Na共有12个故错误;
④稀有气体属于单原子分子,其晶体中不存在化学键,所以固体分子中一定存在分子间作用力,不一定存在化学键,故正确;
⑤元素的非金属性越强,其氢化物越稳定,氢化物的还原性越弱,则HF、HCl、HBr、HI的热稳定性依次减弱,还原性依次增强,故正确;
⑥结构相似的分子晶体,相对分子质量越大,沸点越高,所以F2、Cl2、Br2、I2的沸点依次升高,故正确;
⑦金属Mg的晶胞堆积方式为六方最密堆积,配位数为12; CsCl晶体中阳离子在立方体的中心,阴离子在8个顶点上,所以阴阳离子配位数是8,故错误;
⑧ 中间碳原子上连有四个不一样的基团:氢原子、甲基、羧基和羟基,是手性碳原子,存在对映异构即手性异构体,故正确.
中间碳原子上连有四个不一样的基团:氢原子、甲基、羧基和羟基,是手性碳原子,存在对映异构即手性异构体,故正确.
故选C.
点评 本题考查了化学键、分子间作用力、同分异构题、物质的溶解性规律、晶胞配位数的判断等,题目综合性较强,题目难度中等,侧重于考查学生的分析能力和对基础知识的综合应用能力,注意对相关知识的积累.


 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案 ABC考王全优卷系列答案
ABC考王全优卷系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 增加CO的量 | B. | 增大压强 | C. | 升高温度 | D. | 加入稀有气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 高铁酸钾(K2FeO4)具有极强的氧化性,可作为水处理剂和高容量电池材料.
高铁酸钾(K2FeO4)具有极强的氧化性,可作为水处理剂和高容量电池材料.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 叙述 | 评价 |
| A | 乙酸乙酯在H218O中水解,产物乙醇中将含有18O | 错,根据酯的水解规律,产物乙酸中将含有18O同位素,而乙醇则没有 |
| B | 淀粉与20%的硫酸混合液在沸水浴中充分加热后滴加碘水无蓝色现象,则说明淀粉水解完全 | 错,淀粉水解后未加碱中和至溶液呈碱性 |
| C | 溴乙烷与NaOH溶液共热充分反应后,再加入AgNO3溶液,能观察到浅黄色沉淀 | 对,溴乙烷水解产生了溴离子 |
| D | 可以用新制的Cu(OH)2悬浊液鉴别乙醇溶液、乙酸溶液和葡萄糖溶液 | 错,用新制的Cu(OH)2悬浊液鉴别乙醇溶液和乙酸溶液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石油裂解可获得乙烯、丙烯和丁二烯 | |
| B. | 煤干馏可以得到甲烷、苯和氨等重要化工原料 | |
| C. | 天然植物油常温下一般呈液态,难溶于水,有固定的熔点、沸点 | |
| D. | 酚醛树脂、聚酯纤维(涤纶)都是由缩聚反应制得的高分子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Li2SO4难溶于水 | B. | Li遇浓硫酸产生“钝化”现象 | ||
| C. | LiOH的水溶液不能使酚酞变红 | D. | Li2CO3受热分解,生成Li2O和CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有 x+1 | B. | 可能是 x+8或 x+18 | ||
| C. | 可能是 x+2 | D. | 可能是 x+1或 x+11或x+25 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 化学反应速率是描述化学反应进行快慢程度的物理量.下面是某同学测定化学反应速率并探究其影响因素的实验.
化学反应速率是描述化学反应进行快慢程度的物理量.下面是某同学测定化学反应速率并探究其影响因素的实验.| 实验序号 | 体积V/mL | 时间/s | |||
| Na2S2O3溶液 | 淀粉溶液 | 碘水 | 水 | ||
| ① | 10.0 | 2.0 | 4.0 | 0.0 | t1 |
| ② | 8.0 | 2.0 | 4.0 | 2.0 | t2 |
| ③ | 6.0 | 2.0 | 4.0 | Vx | t3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com