
| A. | Q1+Q2+Q3 | B. | 1.5Q1-0.5Q2+0.5Q3 | ||
| C. | 0.5Q1-0.5Q2+0.5Q3 | D. | 0.5(Q1+Q2+Q3) |
分析 无论化学反应过程是一步完成还是分为数步完成,这个过程的热效应是相同的.依据盖斯定律结合热化学方程式计算得到所求热化学方程式得到焓变.
解答 解:H2O(g)═H2O(l)△H1=-Q1 kJ•mol-1①
C2H5OH(g)═C2H5OH(l)△H2=-Q2 kJ•mol-1②
C2H5OH(g)+3O2(g)═2CO2(g)+3H2O(g)△H=-Q3 kJ•mol-1③
若使23g酒精液体完全燃烧,最后恢复到室温生成的水是液体,依据盖斯定律计算③-②+①×3得到:
C2H5OH(l)+3O2(g)═2CO2(g)+3H2O(l)△H=-(Q3-Q2+3Q1)KJ/mol;
23g酒精物质的量为0.5mol,液体完全燃烧,最后恢复到室温生成的水是液体,放热(1.5Q1-0.5Q2+0.5Q3) kJ,
故选B.
点评 本题考查了热化学方程式的书写方法和盖斯定律的计算应用,注意焓变符号的变化,计量数变化,焓变随之变化,题目较简单.


 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 溶液中的OH-向正极移动 | |
| B. | 在银表面上的反应为:2Al+3Ag2S═6Ag+Al2S3 | |
| C. | 正极反应式为:Ag2S+2e-═2Ag+S2- | |
| D. | 在铝表面的反应为:Al+3OH--3e-═Al(OH)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.4mol/L | B. | 0.2mol/L | C. | 0.1mol/L | D. | 0.08mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质子数为17、中子数为20的氯原子:${\;}_{17}^{20}$Cl | |
| B. | H2CO3的电离方程式:H2CO3?2H++CO32- | |
| C. | Na2O2的电子式: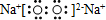 | |
| D. | 乙烯分子的结构简式:CH2CH2. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 人造纤维、合成橡胶和光导纤维都属于有机高分子化合物 | |
| B. | 大力实施矿物燃料“脱硫、脱销技术”,减少硫的氧化物和氮的氧化物污染 | |
| C. | 用聚氯乙烯代替木材,生产包装盒、快餐盒等,以减少木材的使用 | |
| D. | 氢氧燃料电池、硅太阳能电池中都利用了原电池原理 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 容器 | 甲 | 乙 |
| 反应物投入量 | 1mol CO2、3mol H2 | a mol CO2、b mol H2 c mol CH3OH(g)、c mol H2O(g) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com