
”¾ĢāÄæ”湤ŅµÉĻ³£²ÉÓĆĮņĢśæó±ŗÉÕČ”ĮņŗóµÄÉÕŌü£ØÖ÷ŅŖ³É·ÖĪŖFe2O3”¢SiO2”¢Al2O3ÖĘČ”ĘßĖ®ŗĻĮņĖįŃĒĢś£ØFeSO4”¤7H2O£©£¬Éč¼ĘĮ÷³ĢČēĶ¼£ŗ

£Ø1£©ČܽāÉÕŌüŃ”ÓƵÄ×ćĮæµÄĖįµÄĆū³ĘŹĒ___”£
£Ø2£©¹ĢĢå1µÄÖ÷ŅŖ³É·ÖŹĒ___”£
£Ø3£©¼ÓČėŅ©Ę·Xŗó£¬ČÜŅŗ1ÖŠÖ÷ŅŖ·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖ___”£
£Ø4£©“ÓČÜŅŗ2µĆµ½FeSO4”¤7H2O²śĘ·µÄ¹ż³ĢÖŠ£¬ŠėæŲÖĘĢõ¼ž·ĄÖ¹ĘäŃõ»ÆŗĶ·Ö½ā£¬¾¹ż”¢___”¢___¹żĀĖµČ²½ÖčµĆµ½¾§Ģ唣
£Ø5£©ÓŠĶ¬Ń§ČĻĪŖŌŚČÜŅŗ1ÖŠÖ±½Ó¼ÓNaOHÖĮ¹żĮ棬µĆµ½µÄ³ĮµķÓĆĮņĖįČܽā£¬ĘäČÜŅŗ¾½į¾§·ÖĄėŅ²æɵƵ½FeSO4”¤7H2O£¬ÄćČĻĪŖÕāŅ»·½°ø___£ØĢīŠ“”°æÉŠŠ”±»ņ”°²»æÉŠŠ”±£©”£
”¾“š°ø”æĮņĖį SiO2 Fe+2Fe3+=3Fe2+ Õō·¢ÅØĖõ ĄäČ“½į¾§ ²»æÉŠŠ
”¾½āĪö”æ
ĮņĢśæó±ŗÉÕČ”ĮņŗóµÄÉÕŌü(Ö÷ŅŖ³É·ÖĪŖFe2O3”¢SiO2”¢Al2O3£¬²»æ¼ĀĒĘäĖūŌÓÖŹ)ÖŠ¼ÓČė×ćĮæĻ”ĮņĖį£¬·¢ÉśµÄ·“Ó¦ÓŠFe2O3+3H2SO4=Fe2(SO4)3+3H2O”¢Al2O3+3H2SO4=Al2(SO4)3+3H2O£¬SiO2²»ČÜÓŚĻ”ĮņĖį£¬Č»ŗó¹żĀĖ£¬µĆµ½µÄ¹ĢĢå1³É·ÖĪŖSiO2£¬ĀĖŅŗ1ÖŠŗ¬ÓŠFe2(SO4)3”¢H2SO4”¢Al2(SO4)3£»ŌŚĀĖŅŗ1ÖŠ¼ÓČėX£¬Č»ŗó¼ÓČėNaOHČÜŅŗ²¢µ÷½ŚČÜŅŗµÄpH£¬µĆµ½¹ĢĢå2ĪŖAl(OH)3ŗĶČÜŅŗ2£¬“ÓČÜŅŗ2ÖŠÄܵƵ½FeSO47H2O¾§Ģ壬ĖµĆ÷ČÜŅŗ2ÖŠČÜÖŹĪŖFeSO4£¬ŌņX¾ßÓŠ»¹ŌŠŌ£¬Äܽ«Fe3+»¹ŌĪŖFe2+£¬ĒŅ²»ÄÜŅż½ųŠĀµÄŌÓÖŹ£¬ŌņXĪŖFe£¬¼ÓČėŹŌ¼ĮX·¢ÉśµÄĄė×Ó·“Ó¦ÓŠ2Fe3++Fe=3Fe2+”¢Fe+2H+=Fe2++H2”ü£¬½«ČÜŅŗ2Õō·¢ÅØĖõ”¢ĄäČ“½į¾§”¢¹żĀĖµĆµ½FeSO47H2O¾§Ģ壬¾Ż“Ė·ÖĪö½ā“š”£
(1)øł¾Ż×īÖÕ²śĪļĪŖĘßĖ®ŗĻĮņĖįŃĒĢśæÉÖŖČܽāÉÕŌüµÄĖįĪŖĮņĖį£»
(2)¹ĢĢå1ĪŖ²»ČÜÓŚĮņĖįµÄSiO2£»
(3)ŹŌ¼ĮXĪŖFe£¬æÉ»¹ŌĢśĄė×Ó£¬Ąė×Ó·½³ĢŹ½ĪŖFe+2Fe3+=3Fe2+£»
(4)“ÓČÜŅŗÖŠµĆµ½¾§ĢåŅ»°ćŠčŅŖ¾¹żÕō·¢ÅØĖõ”¢ĄäČ“½į¾§”¢¹żĀĖ”¢Ļ“µÓ”¢øÉŌļ£»
(5)ŌŚČÜŅŗ1ÖŠŗ¬ÓŠĢśĄė×ÓŗĶĀĮĄė×Ó£¬¼Ó¹żĮæµÄĒāŃõ»ÆÄĘ£¬ĀĮĄė×Ó×Ŗ»ÆĪŖĘ«ĀĮĖįøłĄė×Ó£¬ĢśĄė×ÓÓėĒāŃõøłĄė×Ó½įŗĻÉś³ÉĒāŃõ»ÆĢś³Įµķ£¬ĖłŅŌ×īÖÕµĆµ½µÄŹĒĮņĖįĢś¶ų²»ŹĒĮņĖįŃĒĢś£¬ĖłŅŌ²»æÉŠŠ”£



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠ³żŌÓÖŹµÄ²Ł×÷·½·ØÕżČ·µÄŹĒ£Ø £©
A.N2 ÖŠÓŠÉŁĮæµÄ CO£ŗĶعż×ĘČȵÄŃõ»ÆĶ
B.Ź³ŃĪÖŠÓŠÉŁĮæµÄ NH4Cl£ŗ¼Ó¹żĮæµÄÉÕ¼īČÜŅŗŗó¼ÓČČÕōøÉ
C.NO ÖŠÓŠÉŁĮæµÄ NO2£ŗÓĆĖ®Ļ“µÓŗóŌŁøÉŌļ
D.NO2 ÖŠÓŠÉŁĮæ NH3£ŗÓĆĖ®Ļ“µÓŗóøÉŌļ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŌŚČŻ»żĪŖ2LµÄĆܱÕČŻĘ÷ÖŠ½ųŠŠČēĻĀ·“Ó¦£ŗA(g)£«2B(g)![]() 3C(g)£«nD(g)£¬æŖŹ¼Ź±AĪŖ4mol£¬BĪŖ6mol£¬5minÄ©“ļµ½Ę½ŗā£¬“ĖŹ±²āµĆCµÄĪļÖŹµÄĮæĪŖ3mol£¬ÓĆD±ķŹ¾µÄ»Æѧ·“Ó¦ĖŁĀŹv(D)ĪŖ0.2mol”¤L£1”¤min£1”£
3C(g)£«nD(g)£¬æŖŹ¼Ź±AĪŖ4mol£¬BĪŖ6mol£¬5minÄ©“ļµ½Ę½ŗā£¬“ĖŹ±²āµĆCµÄĪļÖŹµÄĮæĪŖ3mol£¬ÓĆD±ķŹ¾µÄ»Æѧ·“Ó¦ĖŁĀŹv(D)ĪŖ0.2mol”¤L£1”¤min£1”£
¼ĘĖć£ŗ
£Ø1£©Ę½ŗāŹ±AµÄĪļÖŹµÄĮæÅضČĪŖ___”£
£Ø2£©Ē°5minÄŚÓĆB±ķŹ¾µÄ»Æѧ·“Ó¦ĖŁĀŹv(B)ĪŖ___”£
£Ø3£©»Æѧ·½³ĢŹ½ÖŠnÖµĪŖ__”£
£Ø4£©“Ė·“Ó¦ŌŚĖÄÖÖ²»Ķ¬ĒéæöĻĀµÄ·“Ó¦ĖŁĀŹ·Ö±šĪŖ£ŗ
¢Łv(A)£½5mol”¤L£1”¤min£1
¢Śv(B)£½6mol”¤L£1”¤min£1
¢Ūv(C)£½4.5mol”¤L£1”¤min£1
¢Üv(D)£½8mol”¤L£1”¤min£1
ĘäÖŠ·“Ó¦ĖŁĀŹ×īæģµÄŹĒ__(Ģī±ąŗÅ)”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ³£ĪĀĻĀ£¬![]() ŹĒŅ»ÖÖŅ×ČÜÓŚĖ®µÄ¶žŌŖĖį£¬½«NaOHČÜŅŗµĪČėµČĪļÖŹµÄĮæÅØ¶ČµÄ
ŹĒŅ»ÖÖŅ×ČÜÓŚĖ®µÄ¶žŌŖĖį£¬½«NaOHČÜŅŗµĪČėµČĪļÖŹµÄĮæÅØ¶ČµÄ![]() ČÜŅŗÖŠ£¬ČÜŅŗÖŠ
ČÜŅŗÖŠ£¬ČÜŅŗÖŠ![]() £¬
£¬![]() £¬
£¬![]() µÄĪļÖŹµÄĮæ·ÖŹż
µÄĪļÖŹµÄĮæ·ÖŹż![]() ĖęČÜŅŗpHµÄ±ä»Æ¹ŲĻµČēĶ¼ĖłŹ¾”£ĻĀĮŠĖµ·Ø“ķĪóµÄŹĒ
ĖęČÜŅŗpHµÄ±ä»Æ¹ŲĻµČēĶ¼ĖłŹ¾”£ĻĀĮŠĖµ·Ø“ķĪóµÄŹĒ![]()
![]()
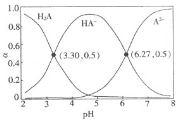
A.³£ĪĀĻĀ£¬![]()
![]() µÄµēĄėĘ½ŗā³£Źż
µÄµēĄėĘ½ŗā³£Źż![]()
B.µ±![]() Ź±£¬ČÜŅŗ³ŹÖŠŠŌ
Ź±£¬ČÜŅŗ³ŹÖŠŠŌ
C.![]() Ź±£¬
Ź±£¬![]()
D.![]() ČÜŅŗ
ČÜŅŗ![]() £ŗ
£ŗ![]() ČÜŅŗ
ČÜŅŗ![]() Ź±£¬
Ź±£¬![]()
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŅŃÖŖĻĀĮŠ·“Ó¦µÄČČ»Æѧ·½³ĢŹ½£ŗ
6C(s)+5H2(g)+3N2(g)+9O2(g)= 2C3H5(ONO2)3(l) ”÷H1£»
H2(g)+ ![]() O2(g)=H2O(g) ”÷H2 £» C(s)+O2(g)=CO2(g) ”÷H3
O2(g)=H2O(g) ”÷H2 £» C(s)+O2(g)=CO2(g) ”÷H3
Ōņ·“Ó¦4C3H5(ONO2)3(l)=12CO2(g)+10H2O(g)+O2(g)+6N2(g)µÄ”÷HĪŖ£Ø””””£©
A.12”÷H3+10”÷H2©2”÷H1B.2”÷H1©10”÷H2©12”÷H3
C.12”÷H3©10”÷H2©2”÷H1D.”÷H1©10”÷H2©12”÷H3
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ2009ÄźĪŅ¹śæĘѧ¼ŅĶعż²āĮæSiO2ÖŠ26AlŗĶ10BeĮ½ÖÖŌŖĖŲµÄ±ČĄżČ·¶Ø”°±±¾©ČĖ”±ÄźĮäµÄŃŠ¾æ½į¹ū£¬ÕāÖÖ²āĮæ·½·Ø½Š”°ĀĮīė²āÄź·Ø”±”£
£Ø1£©ŃŠ¾æ±ķĆ÷26AlæÉŅŌĖ„±äĪŖ26Mg£¬æÉŅŌ±Č½ĻÕāĮ½ÖÖŌŖĖŲ½šŹōŠŌĒæČõµÄ·½·ØŹĒ___”£
a.±Č½ĻÕāĮ½ÖÖŌŖĖŲµÄµ„ÖŹµÄÓ²¶ČŗĶČŪµć
b.ŌŚĀČ»ÆĀĮŗĶĀČ»ÆĆ¾µÄČÜŅŗÖŠ·Ö±šµĪ¼Ó¹żĮæµÄĒāŃõ»ÆÄĘČÜŅŗ
c.½«“ņÄ„¹żµÄĆ¾“ųŗĶĀĮʬ·Ö±šŗĶČČĖ®×÷ÓĆ£¬²¢µĪČė·ÓĢŖČÜŅŗ
d.½«æÕĘųÖŠ·ÅÖĆŅŃ¾ĆµÄÕāĮ½ÖÖŌŖĖŲµÄµ„ÖŹ·Ö±šŗĶČČĖ®×÷ÓĆ
£Ø2£©BeCl2ČŪµć½ĻµĶ£¬Ņ×Éż»Ŗ£¬Ęä»ÆѧŠŌÖŹÓėAlCl3ĻąĖĘ£¬æÉĶĘ²āBeCl2ČŪČŚĢ¬___(Ń”Ģī”°µ¼µē”±»ņ”°²»µ¼µē”±)£¬ĒėŠ“³öBeCl2Ė®½āµÄ»Æѧ·½³ĢŹ½___”£
£Ø3£©ĀĮ¼°Ęä»ÆŗĻĪļŌŚČÕ³£Éś»ī”¢¹¤ŅµÉĻÓŠ¹ć·ŗµÄÓ¦ÓĆ”£¹ś²śC919·É»śĶāæĒÓ¦ÓĆĮĖĀĮŗĻ½š²ÄĮĻ”£ĻĀĮŠĀĮŗĻ½šµÄŠŌÖŹÓėĘäÓĆÓŚ·É»śĶāæĒĪŽ¹ŲµÄŹĒ£Ø_______£©
a.ĆܶȊ” b.Äܵ¼µē c.æ¹øÆŹ“ŠŌÄÜĒæ d.Ó²¶Č“ó
£Ø4£©Al2O3”¢MgOŗĶSiO2¶¼æÉŅŌÖĘÄĶ»š²ÄĮĻ£¬ĘäŌŅņŹĒ___”£
a.Al2O3”¢MgOŗĶSiO2¶¼²»ČÜÓŚĖ® b.Al2O3”¢MgOŗĶSiO2¶¼ŹĒ°×É«¹ĢĢå
c.Al2O3”¢MgOŗĶSiO2¶¼ŹĒŃõ»ÆĪļ d.Al2O3”¢MgOŗĶSiO2¶¼ÓŠŗÜøßµÄČŪµć
£Ø5£©Ć÷·ÆæÉ×÷¾»Ė®¼Į”£Ć÷·Æ(KAl(SO4)2”¤12H2O)µÄĖ®ČÜŅŗ³Ź___ŠŌ(Ń”Ģī”°Ėį”±”¢”°¼ī”±»ņ”°ÖŠ”±)£¬Š“³öĆ÷·ÆŌŚĖ®ČÜŅŗÖŠµÄµēĄė·“Ó¦·½³ĢŹ½___£»ČÜŅŗÖŠĄė×ÓÅØ¶Č“óŠ”Ė³ŠņĪŖ___”£
£Ø6£©ĒāŃõ»ÆĀĮŹĒÓĆĮæ×ī“ó”¢Ó¦ÓĆ×ī¹ćµÄĪŽ»ś×čČ¼Ģķ¼Ó¼Į£¬½āŹĶĒāŃõ»ÆĀĮÄÜ×ö×čČ¼¼ĮµÄŌŅņ___£ØÓĆ·½³ĢŹ½ĖµĆ÷£©£»Š“³öAl(OH)3µÄµēĄė·½³ĢŹ½___”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻņ1LµÄĆܱÕČŻĘ÷ÖŠ¼ÓČė1molX”¢0.3molZŗĶŅ»¶ØĮæµÄYČżÖÖĘųĢ唣Ņ»¶ØĢõ¼žĻĀ·¢Éś·“Ó¦£¬ø÷ĪļÖŹµÄÅضČĖꏱ¼ä±ä»ÆČēĶ¼Ņ»ĖłŹ¾”£Ķ¼¶žĪŖt2Ź±æĢŗóøı䷓ӦĢõ¼ž£¬Ę½ŗāĢåĻµÖŠ·“Ó¦ĖŁĀŹĖꏱ¼ä±ä»ÆµÄĒéæö£¬ĒŅĖÄøö½×¶Ī¶¼ø÷øıäŅ»ÖÖ²»Ķ¬µÄĢõ¼ž”£ĻĀĮŠĖµ·Ø²»ÕżČ·µÄŹĒ
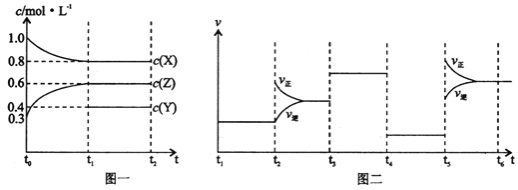
A.YµÄĘšŹ¼ĪļÖŹµÄĮæĪŖ0.5mol
B.øĆ·“Ó¦µÄ»Æѧ·½³ĢŹ½ĪŖ£ŗ2X(g)+Y(g)![]() 3Z(g)H£¼0
3Z(g)H£¼0
C.Čōt0=0£¬t1=10s£¬Ōņt0”«t1½×¶ĪµÄĘ½¾ł·“Ó¦ĖŁĀŹĪŖv(Z)=0.03mol/(L”¤s)
D.·“Ó¦ĪļXµÄ×Ŗ»ÆĀŹt6µć±Čt3µćøß
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠÓŠ¹ŲŅŅ“¼µÄ»Æѧ·½³ĢŹ½ÕżČ·µÄŹĒ
A.Óė½šŹōÄĘ·“Ó¦£ŗ 2CH3CH2OH£«2Na”ś2CH3CH2ONa£«H2”ü
B.ÓėŃõĘųµÄČ¼ÉÕ·“Ó¦£ŗ2CH3CH2OH£«O2![]() 2CH3CHO£«2H2O
2CH3CHO£«2H2O
C.ÓėŃõĘųµÄ“ß»ÆŃõ»Æ£ŗCH3CH2OH£«3O2![]() 2CO2£«3H2O
2CO2£«3H2O
D.ÓėŅŅĖįµÄõ„»Æ·“Ó¦£ŗCH3COOH£«CH3CH2OH![]() CH3COOCH2CH3
CH3COOCH2CH3
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŅŃÖŖ1 gĒāĘųĶźČ«Č¼ÉÕÉś³ÉĖ®ÕōĘųŹ±·Å³öČČĮæ121 kJ£¬ĒŅŃõĘųÖŠ1 mol O=O¼üĶźČ«¶ĻĮŃŹ±ĪüŹÕČČĮæ496 kJ£¬Ė®ÕōĘųÖŠ1mol H-O¼üŠĪ³ÉŹ±·Å³öČČĮæ463 kJ£¬ŌņĒāĘųÖŠ1mol H-H¼ü¶ĻĮŃŹ±ĪüŹÕČČĮæĪŖ
A.920 kJB.557 kJC.436 kJD.188 kJ
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com