
【题目】下列各组溶液中离子,能在溶液中大量共存的是
A. OH-、Ca2+、NO3-、SO32-
B. Ca2+、HCO3-、Cl-、K+
C. NH4+、Ag+、NO3-、I-
D. K+、OH-、Cl-、HCO3-
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】中和热的测定是高中化学中重要的定量实验。取50mL、0.55mol/L的NaOH溶液与50mL、0.25mol/L的H2SO4溶液置于如图所示的装置中进行中和热的测定实验,回答下列问题:
(1)从如图所示实验装置看,其中尚缺少的一种玻璃用品是_____________,除此之外,装置的一个明显错误是___________________________________________________。

(2)NaOH溶液稍过量的原因是_______________________________________________。
(3)若改用60mL、0.25mol/L的H2SO4溶液和50mL、0.55mol/L的NaOH溶液进行反应,与上述实验相比,所放出的热量_____________(填“相等”或“不相等”),若实验操作均正确,则所求中和热_______________(填“相等”或“不相等”)。
(4)倒入NaOH溶液的正确操作是__________
A.沿玻璃棒缓慢倒入 B.分三次少量倒入 C.一次性迅速倒入
(5)实验数据如下表:
温度 实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | 温度差平均值 (t2-t1)/℃ | ||
H2SO4 | NaOH | 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 29.5 | |
2 | 27.0 | 27.4 | 27.2 | 32.3 | |
3 | 25.9 | 25.9 | 25.9 | 29.2 | |
4 | 26.4 | 26.2 | 26.3 | 29.8 | |
①近似认为0.55mol/L NaOH溶液和0.25mol/L H2SO4溶液的密度都是1g/cm3,中和后生成溶液的比热容c=4.18J/(g℃),则中和热△H=__________(取小数点后一位)。
②上述实验的结果与57.3kJ/mol有偏差,产生偏差的原因可能是____________。
A.实验装置保温、隔热效果差
B.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
C.做实验的当天室温较高
D.量取H2SO4时仰视读数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼酸(H2BO3)可以通过电解NaB(OH)4溶液的方法制备,工作原理如图所示。下列有关表述错误的是( )

A. M室的电极反应式为2H2O-4e-=O2↑+4H+
B. N室中,进口和出口的溶液浓度大小关系为a%<b%
C. b膜为阴离子交换膜,产品室发生反应为H++[B(OH)4]-=H3BO3+H2O
D. 理论上每生成1molH3BO3,阴极室可生成5.6L气体(标准状况)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】相对分子质量为92的某芳香烃X是一种重要有机化工原料,研究部门以它为初始原料设计出如下转化关系图(部分产物、合成路线、反应条件略去)。其中A是一氯代物,H是一种功能高分子,链节组成为C7H5NO。
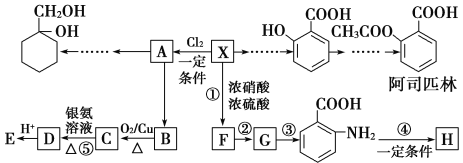
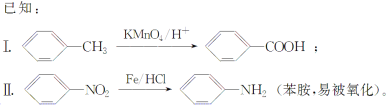
请根据所学知识与本题所给信息回答下列问题:
(1)X的分子中最多有________个原子共面。
(2)H的结构简式为_____________________________________。
(3)反应②、④的类型分别为____________反应、____________反应。
(4)反应⑤的化学方程式是____________________________________________。
(5)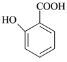 有多种同分异构体,其中含有1个醛基和2个羟基,其核磁共振氢谱图中峰面积之比为1:2:2:1,则符合上述条件的所有同分异构体的结构简式是_______________________。
有多种同分异构体,其中含有1个醛基和2个羟基,其核磁共振氢谱图中峰面积之比为1:2:2:1,则符合上述条件的所有同分异构体的结构简式是_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种熔融碳酸盐燃料电池原理示意如图。下列有关该电池的说法正确的是
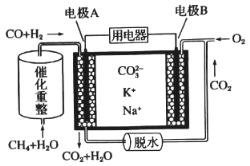
A. 电池工作时,CO32-向电极B移动
B. 电极A上H2参与的电极反应为H2+2OH--2e-=2H2O
C. 反应CH4+H2O![]() 3H2+CO,每消耗1 mol CH4参加反应共转移6mol电子
3H2+CO,每消耗1 mol CH4参加反应共转移6mol电子
D. 电极B上发生的电极反应为O2+4e-+2H2O=4OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质在生产、生活中应用时,起还原作用的是 ( )
A. 铁粉作食品袋内的脱氧剂 B. 纯碱作除酸剂
C. 生石灰在烧煤时作脱硫剂 D. 明矾作净水剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,容积一定的密闭容器中发生反应A(s)+2B(g)![]() C(g)+D(g),当下列物理量不再发生变化时,表明反应已达平衡的是
C(g)+D(g),当下列物理量不再发生变化时,表明反应已达平衡的是
①混合气体的密度 ②混合气体的压强 ③B的物质的量浓度 ④混合气体的总物质的量
A. ①② B. ②③ C. ①③ D. ①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种三室微生物燃料电池可用于污水净化、海水淡化,其工作原理如图所示。以下说法不正确的是
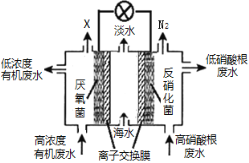
A. 中间室Cl—移向左室 B. 处理后的含硝酸根废水pH降低
C. X气体为CO2 D. 电路中每通过1 mol电子,产生标准状况下氮气的体积为2.24L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醋酸乙烯(CH3COOCH=CH2)是一种重要的有机化工原料,以二甲醚(CH3OCH3)与合成气(CO、H2)为原料,醋酸锂、碘甲烷等为催化剂,在高压反应釜中一步合成醋酸乙烯及醋酸。
回答下列问题:
(1)常温下,将浓度均为a mol/L的醋酸锂溶液和醋酸溶液等体积混合,测得混合液的pH=b,则混合液中c(CH3COO-)=______mol/L( 列出计算式即可)。
(2)合成二甲醚:
Ⅰ.2H2(g)+CO(g)=CH3OH(g) ΔH1=-91.8kJ/mol;
Ⅱ.2CH3OH(g)=CH3OCH3(g)+H2O(g) ΔH2=-23.5 kJ/mol;
Ⅲ.CO(g)+H2O(g)=CO2(g)+H2(g) ΔH3=-41.3 kJ/mol.
已知:H-H 的键能为436kJ/mol,C=O的键能为803kJ/mol,H-O的键能为464kJ/mol,则C≡O的键能为_____kJ/mol.
(3)二甲醚(DME)与合成气一步法合成醋酸乙烯(VAC)的反应方程式为2CH3OCH3(g)+4CO(g)+H2(g) ![]() CH3COOCH=CH2(g)+2CH3COOH(g),T℃时,向2L恒容密闭反应釜中加入0.2 molCH3OCH3、0.4 molCO、0.1molH2发生上述反应,10min达到化学平衡,测得VAC的物质的量分数为10%。
CH3COOCH=CH2(g)+2CH3COOH(g),T℃时,向2L恒容密闭反应釜中加入0.2 molCH3OCH3、0.4 molCO、0.1molH2发生上述反应,10min达到化学平衡,测得VAC的物质的量分数为10%。
①0~10min内,用CO浓度变化表示的平均反应速率v(CO)=______;该温度下,该反应的平衡常数K=__________。
②下列能说明该反应达到平衡状态的是______(填选项字母)。
A.V正(DME)=v逆(H2)≠0
B.混合气体的密度不再变化
C.混合气体的平均相对分子质量不再变化
D.c(CO):c(VAC)=4:1
③如图是反应温度对二甲醚(DME)的转化率和醋酸乙烯(VAC)选择性(醋酸乙烯的选择性Svac=![]() )的影响,该反应的ΔH______0(填“>”“<”或“=”);控制的最佳温度是___________.
)的影响,该反应的ΔH______0(填“>”“<”或“=”);控制的最佳温度是___________.
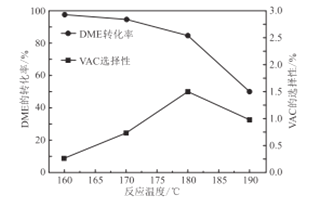
④保持温度不变,向反应釜中通入氩气增大压强,则化学平衡______(填“向正反应方向”“向逆反应方向"或“不”)移动。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com