
 2016年9月.“乔歌里1号”中国首台静默移动发电站MFC30正式问世,MFC30是基于甲醇重整制氢燃料电池发电技术.
2016年9月.“乔歌里1号”中国首台静默移动发电站MFC30正式问世,MFC30是基于甲醇重整制氢燃料电池发电技术.分析 (1)①Ⅰ.CH3OH(g)+H2O(g)?CO2(g)+3H2(g)△H1=+49.4kJ/mol
Ⅱ.CH3OH(g)?CO(g)+2H2(g)△H2=+90.6kJ/mol
Ⅲ.CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H3=-283.0kJ/mol,
结合盖斯定律计算,Ⅱ+Ⅲ得到所需热化学方程式;
②反应化学方程式定量关系计算得到;
(2)CH3OH(g)+H2O(g)?CO2(g)+3H2(g)△H1=+49.4kJ/mol
①平衡常数K=$\frac{生成物平衡浓度幂次方乘积}{反应物平衡浓度幂次方乘积}$;
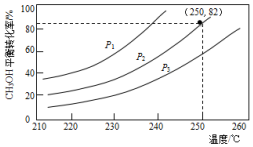
②当温度为250℃、压强为P2时,图象中甲醇转化率为82%,结合化学平衡三行计算得到;
③温度一定,压强越大平衡逆向进行,甲醇转化率减小,据此分析;
(3)该原电池为氢气燃料电池,通入燃料的电极为负极、通入氧化剂的电极为正极,负极是氢气,正极为氧气,据此分析解答.
解答 解:(1)①a.CH3OH(g)+H2O(g)?CO2(g)+3H2(g)△H1=+49.4kJ/mol
b.CH3OH(g)?CO(g)+2H2(g)△H2=+90.6kJ/mol
c.CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H3=-283.0kJ/mol,
结合盖斯定律计算,b+c得到反应Ⅲ的热化学方程式:CH3OH(g)+$\frac{1}{2}$O2(g)=CO2(g)+2H2(g)△H=-192.4 kJ/mol,
故答案为:CH3OH(g)+$\frac{1}{2}$O2(g)=CO2(g)+2H2(g)△H=-192.4 kJ/mol;
②反应Ⅰ1mol甲醇反应生成3mol氢气,反应Ⅱ中1mol甲醇反应生成2mol氢气,反应Ⅲ中1mol甲醇反应生成2mol氢气,则等量的甲醇产生氢气最多的是反应Ⅰ,
故答案为:Ⅰ;
(2)①CH3OH(g)+H2O(g)?CO2(g)+3H2(g)△H1=+49.4kJ/mol,反应的平衡常数K=$\frac{c(C{O}_{2}){c}^{3}({H}_{2})}{c(C{H}_{3}OH)c({H}_{2}O)}$,
故答案为:$\frac{c(C{O}_{2}){c}^{3}({H}_{2})}{c(C{H}_{3}OH)c({H}_{2}O)}$;
②当温度为250℃、压强为P2时,图象中甲醇转化率为82%,合成器组成n(CH3OH):n(H2O)=1:1时设为m,
CH3OH(g)+H2O(g)?CO2(g)+3H2(g)
起始量(mol) m m 0 0
变化量(mol) 82%m 82%m 82%m 3×82%m
平衡量(mol) 18%m 18%m 82%m 3×82%m
反应达平衡时H2的体积分数=$\frac{3×82%m}{18%m+18%m+82%m+3×82%m}$×100%=67.6%,
故答案为:67.6%;
③温度一定,压强越大平衡逆向进行,甲醇转化率减小,P1<P2<P3,
故答案为:P1<P2<P3;
(3)燃料电池是以氢为燃料,Li2CO3与K2CO3混合的碳酸盐为电解质的高温型燃料电池,燃料在负极发生氧化反应,电极反应H2+2e-+CO32-=H2O+CO2,正极是通入氧气、二氧化碳发生还原反应,
故答案为:H2+2e-+CO32-=H2O+CO2;O2(或空气)、CO2.
点评 本题考查了热化学方程式书写和盖斯定律的计算应用、化学平衡计算、影响平衡因素分析判断、原电池原理和电极反应书写,掌握基础是解题关键,题目难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
| 金属 离子 | pH | |
| 开始沉淀 | 完全沉淀 | |
| Fe2+ | 7.6 | 9.6 |
| Cu2+ | 4.4 | 6.4 |
| Fe3+ | 2.7 | 3.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol FeI2与足量氯气反应时转移的电子数为2NA | |
| B. | 常温下,56g铁片投入足量浓H2SO4中生成NA个SO2分子 | |
| C. | 1molCl2参加的氧化还原反应,反应过程中转移电子数都是2NA | |
| D. | 常温常压下,92gNO2和N2O4混合气体含有的原子数为6NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 为避免废旧电池中重金属对环境的污染,可将其深埋 | |
| B. | 为防止海鲜产品腐烂,可将其浸泡在甲醛溶液中 | |
| C. | 利用太阳能代替化石燃料,可改善空气质量 | |
| D. | 利用催化剂可将汽车尾气全部转化为无害气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 NO2与SO2能发生反应:NO2+SO2?SO3+NO,某研究小组对此进行相关实验探究.
NO2与SO2能发生反应:NO2+SO2?SO3+NO,某研究小组对此进行相关实验探究.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 当a=l.0时,反应的离子方程式为:Ba2++2OH-+CO2═BaCO3↓+H2O | |
| B. | 当a=2时,反应的离子方程式为:Ba2++3OH-+2CO2═BaCO3↓+HCO3-+H2O | |
| C. | 当a=2.5时,反应的离子方程式为:OH-+CO2═HCO3- | |
| D. | 当a=1.75时,溶液中HCO3-与CO32-的物质的量之比为2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
.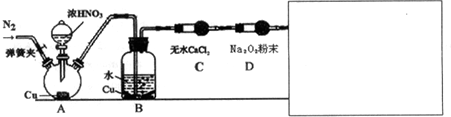
| 实验学生 | 实验操作 | 现象与结论 |
| 甲 | 滴入浓硝酸前,需先打开弹簧夹,通入一段时间N2,目的是将装置中的空气排出.关闭弹簧夹,打开分液漏斗活塞,加入适量浓硝酸后关闭活塞. | 酸性高锰酸钾溶液不褪色,说明Na2O2能完全吸收NO, |
| 乙 | 去掉装置B,直接将A、C装置相连.打开分液漏斗活塞,加入适量浓硝酸后关闭活塞. | 与甲同学现象相似,说明Na2O2能完全吸收NO2 |
| 丙 | 在乙同学装置的基础上,将A装置中浓硝酸换成浓硫酸,并进行加热,(或将分液漏斗中的试剂换为浓硫酸,将铜换为亚硫酸钠粉末),打开分液漏斗活塞,加入适量试剂后关闭活塞. | 与甲同学现象相似,说明Na2O2能完全吸收NO2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com