
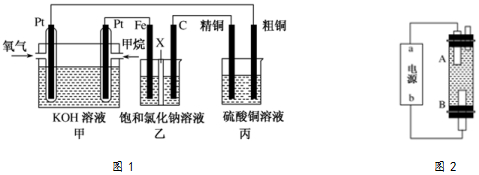
分析 燃料电池中,投放燃料的电极是负极,投放氧化剂的电极是正极;
(1)燃料电池中,负极上投放燃料,负极上失电子发生氧化反应;
(2)甲中投放氧化剂的电极是正极,所以乙装置中石墨是阳极,阳极上氯离子失电子发生氧化反应;
(3)根据串联电池中转移电子数相等计算铁电极上生成氢气的体积、丙装置中析出铜的质量;
(4)若用于制Fe(OH)2,使用硫酸钠做电解质溶液,阴极上氢离子放电生成氢气,阳极上铁失电子生成亚铁离子,亚铁离子和氢氧化钠反应生成氢氧化亚铁;
(5)粗铜精炼时,粗铜作阳极,阳极上金属失电子,阴极上铜离子得电子,根据阴阳极上金属的变化确定溶液中铜离子是否变化.
解答 解:(1)燃料电池中,负极上投放燃料所以投放甲烷的电极是负极,负极上失电子发生氧化反应,电极反应式为:CH4+10OH--8e-=CO32-+7H2O,正极上是氧气得电子的还原反应,电极反应式为:O2+2H2O+2e-═4OH-;故答案为:O2+2H2O+2e-═4OH-;
(2)甲中投放氧化剂的电极是正极,所以乙装置中石墨电极是阳极,阳极上氯离子失电子发生氧化反应,电极反应式为:2Cl--2e-=Cl2↑;
故答案为:2Cl--2e-=Cl2↑;
(3)串联电池中转移电子数相等,若在;准状况下,有2.24L氧气参加反应,则转移电子的物质的量=$\frac{2.24L}{22.4L/mol}$=0.1mol,乙装置中铁电极上氢离子放电生成氢气,设生成氢气的体积为xL;丙装置中阴极上析出铜,设析出铜的质量为yg.
2H++2e-=H2↑
2mol 22.4L
0.4mol xL
x=4.48
2Cu 2++2e-=Cu
2mol 64g
0.4mol yg
y=12.8
故答案为:4.48;12.8;
(4)如果阳极是惰性电极,阳极上氢氧根离子放电生成氧气得不到氢氧化亚铁,所以阳极上应该是铁失电子生成亚铁离子,亚铁离子和氢氧化钠反应生成氢氧化亚铁.
故答案为:铁;
(5)如果粗铜中含有锌、银等杂质,阳极上不仅铜还有锌失电子进入溶液,银沉积在阳极附近,形成电极泥,阴极上析出铜,根据转移电子数相等知,阳极上溶解的铜小于阴极上析出的铜,所以丙装置中反应一段时间,硫酸铜溶液浓度将减小;
故答案为:Ag;减小.
点评 本题考查了原电池和电解池原理及物质的量的有关计算,为高频考点,侧重于学生的分析、计算能力的考查,难点是(4)题中电解质溶液的选取及电极材料的选取,根据实验目的进行正确选取即可.


 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 吸热反应是由于反应物的总能量比生成物的总能量低 | |
| B. | 放热反应的△H<0 | |
| C. | 需要加热才能发生反应一定是吸热反应 | |
| D. | 酸碱中和反应都是放热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 的过程中发生的反应类型为( )
的过程中发生的反应类型为( )| A. | ①④⑥ | B. | ⑤②③ | C. | ⑥②③ | D. | ②④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
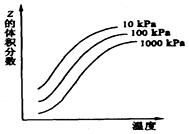
| A. | 正反应为放热 | |
| B. | 其他条件不变,升高温度,X和Y的转化率均降低 | |
| C. | X、Y、Z均为气态 | |
| D. | Z为气态,X和Y只有一种气态 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2O2可用作呼吸面具中氧气的来源 | |
| B. | 硅酸钠可作木材防火剂的原料 | |
| C. | 二氧化硫在葡萄酒中起漂白作用 | |
| D. | 还原铁粉可用于食品包装袋内的脱氧剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | Al2O3(Fe2O3)用盐酸 | B. | Al2O3(SiO2)用氢氧化钠溶液 | ||
| C. | NaHCO3溶液(Na2CO3)通入过量CO2 | D. | NaHCO3溶液(Na2SiO3)通入过量CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加热使I2升华,可除去铁粉中的I2 | |
| B. | 电解熔融的氯化铝,可制备铝单质 | |
| C. | 加入烧碱溶液,充分振荡,静置,分液,可除去苯中的苯酚 | |
| D. | 将氨水滴加到饱和FeC13溶液中,可制备Fe(OH)3胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同一周期元素的原子,半径越小越容易失去电子 | |
| B. | 同一周期元素的最高化合价从左到右从+1递增到+7 | |
| C. | IA族与ⅦA族元素间形成的化合物,有共价化合物也有离子化合物 | |
| D. | 非金属元素形成的共价化合物中,原子的最外层都达到8电子稳定结构 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com