
| A. | 氯水中加少量的Na2 CO3粉末,可提高溶液中HC1O的浓度 | |
| B. | 金属单质都具有一定的还原性,金属阳离子都只有氧化性 | |
| C. | 氯气泄漏,自救方法是用湿毛巾或蘸有纯碱溶液的毛巾捂住口鼻并向地势高的地方撤离 | |
| D. | 大气中的N2可作为制硝酸的原料 |
分析 A、氯水中的盐酸可以和碳酸钠之间反应,促使氯气和水的反应:Cl2+H2O?HCl+HClO正向移动,据此回答;
B、金属单质都具有一定的还原性,金属阳离子大多数均有氧化性,但是还有的具有还原性;
C、氯气的密度比空气大,地势低的地方氯气含量高;
D、空气中的氮气是制造硝酸和氮肥的重要原料.
解答 解:A、氯水中的盐酸可以和碳酸钠之间反应,促使氯气和水的反应:Cl2+H2O?HCl+HClO正向移动,提高溶液中HC1O的浓度,故A正确;
B、金属阳离子也可能具有还原性,如Fe2+,故B错误;
C、氯气的密度比空气大,地势低的地方氯气含量高,则氯气泄漏,自救方法是用湿毛巾捂住口鼻并向地势高的地方撤离,故C正确;
D、空气中的氮气具有广泛的用途,它是制造硝酸和氮肥的重要原料,故D正确;
故选B.
点评 本题涉及氯气性质的考查,注意教材知识的梳理和归纳以及灵活应用是关键,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | v正(CH3OH)=v正(CO2) | B. | 混合气体的密度不变 | ||
| C. | c(CH3OH)=c(H2O) | D. | 混合气体的总物质的量不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu→Cu(OH)2 | B. | CaCl2→CaO | C. | Fe2O3→Fe | D. | Cu(NO3)2→AgNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钢铁在潮湿空气中的腐蚀主要是化学腐蚀 | |
| B. | 金属的化学腐蚀的实质是:M-ne-═Mn+ | |
| C. | 金属的化学腐蚀必需在酸性条件下进行 | |
| D. | 在潮湿的中性环境中,金属的电化学腐蚀主要是析氢腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化还原反应中的反应物,不是氧化剂就是还原剂 | |
| B. | 氧化钠是强电解质 | |
| C. | 能导电的物质一定是电解质 | |
| D. | 溶液、胶体这两种分散系的本质区别是否有丁达尔现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 材料的不断发展可以促进社会进步.
材料的不断发展可以促进社会进步.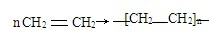 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定条件下,将1 mol N2和3 mol H2混合,充分反应后转移的电子数为6NA | |
| B. | 6.4 g由S2、S4、S8组成的混合物含硫原子数为0.2 NA | |
| C. | 11 g超重水(T2O)含中子数为5NA | |
| D. | 常温常压下,11.2 L Cl2含氯原子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
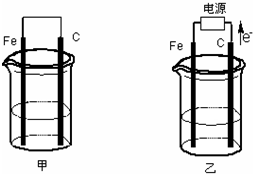 甲、乙两池电极材料都是铁棒与碳棒(如图).请回答下列问题:
甲、乙两池电极材料都是铁棒与碳棒(如图).请回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com