
【题目】目前,处理锌矿进行综合利用,多采用传统的“高氧酸浸法”,但该法也存在一些缺点。最近,有文献报道:用高铁闪锌矿(含有ZnS、FeS、CuS、CdS及少量SiO2等)为原料,采用“高氧催化氧化氨浸法”可以联合制取Cu2O(红色)、CdS(黄色)、锌钡白(白色)三种颜料,其流程如图:
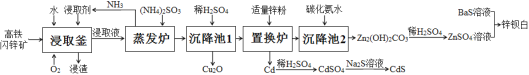
已知:
Ⅰ:浸取剂由碳酸铵、氨水、双氧水等组成;
Ⅱ:浸渣为S、Fe(OH)CO3、SiO2等不溶性物质;
Ⅲ:浸取液中含有[Zn(NH3)4]2+、[Cu(NH3)4]2+、[Cd(NH3)4]2+;
Ⅳ:Cu+在溶液中不存在,但可以与NH3形成稳定的[Cu(NH3)2]+。
回答下列问题:
(1)为加快浸取速度,可以采取的措施是(任答两项)_______;在实际生产中采取常温下浸取而不采用加热的方法,其原因是___。
(2)浸取釜中有O2参与生成浸渣Fe(OH)CO3的离子方程式为_______。
(3)蒸发炉中加入(NH4)2SO3的主要作用是_________;沉降池1中加入稀H2SO4的作用是_______。
(4)在制取ZnSO4和CdSO4时使用硫酸的量要适当,如果硫酸过量,产生的后果是______。
(5)无论采用“高氧酸浸法”还是“高氧催化氧化氨浸法”,其前期处理,都要经过用浸取剂浸取这一步,不同的是“高氧酸浸法”需先高温焙烧,然后再用硫酸浸出。两种方法比较,“高氧酸浸法”存在的缺点是(任答两条)__________。
【答案】粉碎矿石,增大O2压强,增大氨水和碳酸铵的浓度 防止NH3的挥发,以便形成稳定的配合物,防止双氧水分解 4FeS+3O2+4CO32-+6H2O=4Fe(OH)CO3↓+4S↓+8OH- 将[Cu(NH3)4]2+还原为[Cu (NH3)2]+ 调节溶液的pH,使[Cu(NH3)2]+转化为Cu2O沉淀 产生H2S气体污染大气;降低锌钡白、CdS的产量 能耗高;设备耐酸性要求高;产生大量有害气体(SO2)污染大气
【解析】
由题干信息,分析流程图可知,高铁闪锌矿在浸取釜中与O2、碳酸铵、氨水、双氧水等组成的浸取剂反应生成S、Fe(OH)CO3、SiO2等不溶性物质、[Zn(NH3)4]2+、[Cu(NH3)4]2+和[Cd(NH3)4]2+,在蒸发炉中加入(NH4)2SO3将[Cu(NH3)4]2+还原为[Cu (NH3)2]+,进入沉降池1中加入稀H2SO4调节pH使[Cu(NH3)2]+转化为Cu2O沉淀,剩下的溶液在置换炉中加入适量锌粉得到Cd单质,滤液进入沉降池2加入碳化氨水得到Zn2(OH)2CO3,经稀硫酸得到ZnSO4溶液,ZnSO4与BaS溶液反应得到锌钡白,据此分析解答问题。
(1)由化学反应速率的影响因素可以知道,可采用粉碎矿石,增大O2压强,增大氨水和碳酸铵的浓度等方法加快浸取速率,由于浸取剂由碳酸铵、氨水、双氧水等组成,受热易分解,故在实际生产中采取常温浸取而不采用加热的方法,故答案为:粉碎矿石,增大O2压强,增大氨水和碳酸铵的浓度;防止NH3的挥发,以便形成稳定的配合物,防止双氧水分解;
(2)浸取釜中O2与碳酸铵和FeS反应生Fe(OH)CO3、S,反应的离子方程式为4FeS+3O2+4CO32-+6H2O=4Fe(OH)CO3↓+4S↓+8OH-,故答案为:4FeS+3O2+4CO32-+6H2O=4Fe(OH)CO3↓+4S↓+8OH-;
(3)Cu+在溶液中不存在,但可以与NH3形成稳定的[Cu(NH3)2]+,根据上述分析,(NH4)2SO3
中SO32-具有还原性,在蒸发炉中加入(NH4)2SO3可将[Cu(NH3)4]2+还原为[Cu (NH3)2]+,从而加入稀H2SO4调节pH使[Cu(NH3)2]+转化为Cu2O沉淀,故答案为:将[Cu(NH3)4]2+还原为[Cu (NH3)2]+;调节溶液的pH,使[Cu(NH3)2]+转化为Cu2O沉淀;
(4)在制取ZnSO4和CdSO4时使用硫酸过量会产生H2S气体污染大气并降低锌钡白、CdS的产量,故答案为:产生H2S气体污染大气,降低锌钡白、CdS的产量;
(5) “高氧酸浸法”需先高温焙烧,然后再用硫酸浸出,此法需要在高温条件,能耗高;对设备的耐酸性要求高;同时会产生大量有害气体(SO2)污染大气,故答案为:能耗高、设备耐酸性要求高、产生大量有害气体(SO2)污染大气。


 导学与测试系列答案
导学与测试系列答案 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】某化学小组用如图所示装置验证卤素单质氧化性的相对强弱。下列说法不正确的是( )
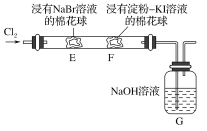
A.E处棉花球变成黄色,说明Cl2的氧化性比Br2强
B.F处棉花球变成蓝色,说明Br2的氧化性比I2强
C.E处发生反应的离子方程式为:Cl2+2Br-===2Cl-+Br2
D.G装置中NaOH溶液与Cl2反应的离子方程式为:2OH-+Cl2===ClO-+Cl-+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】选择完成下列实验的装置。

(1)分离水和植物油,选用____________(填序号,下同)。
(2)用乙酸、乙醇和浓硫酸制备乙酸乙酯,选用____________。
(3)加热NH4Cl和Ca(OH)2固体混合物制取NH3,用____________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物X是淀粉水解的最终产物;Y俗名酒精;Z是一种植物生长调节剂,可以把果实催熟,在催化剂作用下,Z可以制得重要的包装材料P。
请回答下列问题:
(1)X的分子式为___。
(2)Y与Na反应的化学方程式为___。
(3)Z→P反应的化学方程式为___,属___反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮、硒形成的单质及其化合物有重要的科学研究价值,请回答下列问题:
(1)邻氨基吡啶的铜配合物在有机不对称合成中起催化诱导效应,其结构简式如图所示。基态氮原子的价电子轨道表示式为______________;其核外电子共占据____个能级;邻氨基吡啶的铜配合物中Cu2+的配位数是_______。

(2)高聚氮晶体结构如图所示,每个氮原子与另外三个氮原子结合形成空间网状结构。固态高聚氮是_______晶体;该晶体中n(N)与n(N—N)之比为_______;这种高聚氮N—N键的键能为160 kJ·mol-1,而N2的键能为942 kJ·mol-1,其可能潜在的应用是__________。

(3)NO3-的空间构型是________;HNO3的酸性比HNO2强,试从结构的角度解释其原因__________。
(4)硒有三种晶体(α单斜体、β单斜体和灰色三角晶),灰硒的晶体为六方晶胞结构,原子排列为无限螺旋链,分布在六方晶格上,同一条链内原子作用很强,相邻链之间原子作用较弱,其螺旋链状图、晶胞结构图和晶胞俯视图如图所示:

已知正六棱柱的边长为acm,高为bcm,阿伏加德罗常数的值为NA,则该晶体的密度为_____g·cm-3(用含NA、a、b的式子表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究和深度开发CO、CO2的应用具有重要的社会意义。回答下列问题:
(1)CO可用于高炉炼铁,已知:
Fe3O4(s)+4CO(g)=3Fe(s)+4CO2 (g) △H1= a kJ/mol
3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2 (g) △ H2= b kJ/mol
则反应Fe2O3(s)+3CO(g)=2Fe(s)+3CO2 (g)的△H=________kJ/mol
(2)某温度下,在容积为2 L的密闭容器甲中投入8molCO2(g)、16molH2(g)发生反应:
CO2 (g)+H2(g) ![]() CO(g)+H2O(g)
CO(g)+H2O(g)
甲容器15 min后达到平衡,此时CO2的转化率为75%。则015 min内用二氧化碳表示平均反应速率v(CO2)=_______,计算此条件下该反应的平衡常数K= __________。
(3)捕碳技术是指从空气中捕获二氧化碳的各种科学技术的统称。目前NH3和(NH4)2CO3等物质已经被用作工业捕碳剂。
①下列物质中不可能作为CO2捕获剂的是___________。
A.Na2CO3 B.NaOH C.CH3CH2OH D.NH4Cl
②用(NH4)2CO3捕碳的反应:(NH4)2CO3(aq)+H2O(l)+CO2(g) ![]() 2NH4HCO3(aq)。为研究温度对(NH4)2CO3捕获CO2效率的影响,将一定量的(NH4)2CO3溶液置于密闭容器中,并充入一定量的CO2气体,保持其它初始实验条件不变,分别在不同温度下,经过相同时间测得CO2气体浓度,得到趋势图:
2NH4HCO3(aq)。为研究温度对(NH4)2CO3捕获CO2效率的影响,将一定量的(NH4)2CO3溶液置于密闭容器中,并充入一定量的CO2气体,保持其它初始实验条件不变,分别在不同温度下,经过相同时间测得CO2气体浓度,得到趋势图:
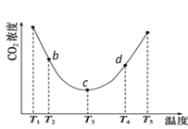
I. c点的逆反应速率和d点的正反应速率的大小关系为
V逆c _____V正d (填“>”、“=”或“<”)
II. b、c、d三点的平衡常数K b 、K c、 Kd 从大到小的顺序为_______。(填“>”、“=”或“<”)
III.T3~T4温度区间,容器内CO2气体浓度呈现增大的变化趋势,其原因是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】TMB是一种新型指纹检测的色原试剂,由碳、氢、氮三种元素组成,M=240g·mol—1。某研究性学习小组的同学欲利用下列仪器测定TMB的分子式。主要过程为在足量氧气流中将4.80 g TMB样品氧化(氮元素转化为N2),再利用吸收剂分别吸收水蒸气和CO2。请从图中选择适当的装置(装置符合气密性要求,加热装置等已略去,其他用品可自选)。
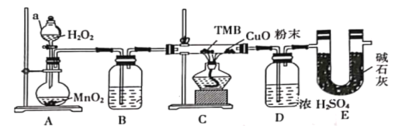
(1) 写出A中的化学反应方程式:__________________;
(2) B 中试剂是___________,作用是________________ ;
(3) 装置C中CuO粉末的作用为________________。
(4) 理想状态下,将4.80 gTMB样品完全氧化,点燃C处酒精灯,实验结束时测得D增加3.60 g,E增加14.08 g,则TMB的分子式为____________。
(5)有同学认为,用该实验装置测得的TMB分子式不准确,应在干燥管E后再添加一个装有碱石灰的干燥管F。你认为是否需要添加F装置__________(填“需要”或“不需要”),简述理由________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是锌片和铜片在稀硫酸中所组成的原电池装置,c、d为两个电极。下列有关的判断不正确的是

A. 电池工作的过程中,d电极上产生气泡
B. 电池工作时,溶液中SO42-向d移动
C. c为负极,发生氧化反应
D. 电池工作的过程中,溶液中SO42-浓度基本不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人类农业生产离不开氮肥,科学合理使用氮肥,不仅能提高化肥的使用率,而且能够更好地保护环境,请回答下列问题:
(1)工业合成氨是制取氮肥的基础。合成氨反应中,反应物 N2 的结构式是_______________,产物NH3 的电子式是_________________。
(2)某小组在实验室模拟以 NH3 为原料, 制备少量硝态氮肥 Ca(NO3)2,转化途径如下(转化所需试剂及条件已略去)。
![]()
①NO→NO2 的现象是______________, NO2→HNO3 的化学方程式为____________________。
②将HNO3 转化为 Ca(NO3)2,列举两种不同类别的化合物 M___________________(写化学式) 。
(3)①NH4HCO3 是一种铵态氮肥,需阴凉处保存,原因是_______________(写化学方程式)。
②实验室检验某化肥是铵态氮肥,检验过程中发生反应的离子方程式为___________________。
(4)过渡施用氮肥将导致大气中NH3含量增高,加剧雾霾的形成。(NH4)2SO4是雾霾的成分之一,其形成过程如下图所示(转化所需试剂及条件已略去) 
①X可能是SO3 或_______________,Y是_____________。
②尿素CO(NH2)2是一种常用有机氮肥,缓慢与 H2O 发生非氧化还原反应释放出NH3和另外一种气体,该反应的化学方程式为________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com