
| A. | PH3 sp2 平面三角形 | B. | SO32- sp2 平面三角形 | ||
| C. | SO2 sp2 V形 | D. | NO3- sp3 三角锥形 |
分析 根据价层电子对互斥理论确定原子杂化和分子空间构型,价层电子对个数=σ键个数+孤电子对个数,据此分析解答.
解答 解:A.PH3中P原子价层电子对个数是4且含有一个孤电子对,所以P原子采用sp3杂化,但该分子为三角锥形结构,故A错误;
B.SO32-中S原子价层电子对个数是4且含有一个孤电子对,所以S原子采用sp3杂化,但该离子为三角锥形结构,故B错误;
C.三角锥形SO2中S原子价层电子对个数是3且含有一个孤电子对,所以S原子采用sp2杂化,该分子为V形结构,故C正确;
D.NO3-中N原子价层电子对个数是3且不含孤电子对,所以N原子采用sp3杂化,且该离子为平面三角形结构,故D错误;
故选C.
点评 本题考查微粒空间构型及原子杂化方式判断,为高频考点,明确价层电子对互斥理论内涵是解本题关键,难点是孤电子对计算方法,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 序号 | 1 | 2 | 3 | 4 | 5 | 6 |
| 导管及仪器 |  |  |  |  |  |  |
| 每个橡皮塞上都打了两个孔 | ||||||
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
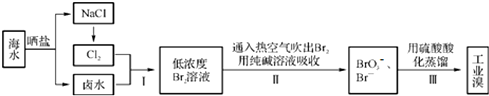
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠熔成光亮的小球,在液面四处游动 | |
| B. | 有气体产生 | |
| C. | 溶液底部有银白色的物质 | |
| D. | 溶液变浑浊 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com