
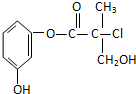
| A、该有机物与溴水可发加成反应 |
| B、该有机物与浓硫酸混合共热可发生消去反应 |
| C、1 mol该有机物与足量NaOH溶液反应最多消耗3 mol NaOH |
| D、该有机物经催化氧化后与新制氢氧化铜悬浊液共热生成砖红色沉淀 |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CH4、NH3、H2O、三种分子的空间构型虽然不同,但中心原子的轨道杂化类型却相同 |
B、苯乙烯( )分子中的所有原子,不可能在同一平面内 )分子中的所有原子,不可能在同一平面内 |
| C、质谱仪可以测定有机化合物的相对分子质量 |
| D、红外光谱可以反映有机化合物中化学键或者官能团的相关信息 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、定容时俯视液面 |
| B、转移溶液前溶液未冷却至室温 |
| C、容量瓶未干燥 |
| D、未洗涤烧杯和玻璃棒 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1:9 | B、1:11 |
| C、9:1 | D、11:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
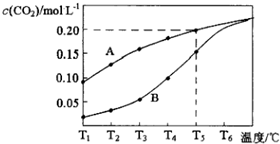 在一个体积为2L的真空密闭容器中加入0.5molCaCO3,发生反应CaCO3(s)═CaO (s)+CO2(g),测得二氧化碳的物质的量浓度随温度的变化关系如图表示,图中A表示CO2的平衡浓度与温度的关系曲线,B表示不同温度下反应经过相同时间时CO2的物质的量浓度的变化曲线.请按要求回答下列问题:
在一个体积为2L的真空密闭容器中加入0.5molCaCO3,发生反应CaCO3(s)═CaO (s)+CO2(g),测得二氧化碳的物质的量浓度随温度的变化关系如图表示,图中A表示CO2的平衡浓度与温度的关系曲线,B表示不同温度下反应经过相同时间时CO2的物质的量浓度的变化曲线.请按要求回答下列问题:| 物质 | 电离平衡常数(25℃) |
| C6H5OH | Ki=1.28×10-10 |
| H2CO3 | Ki1=4.3×10-7 |
| Ki2=5.6×10-11 |
查看答案和解析>>
科目:高中化学 来源: 题型:
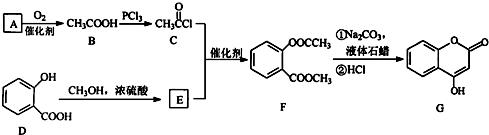
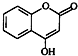 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1mol任何物质都约含有6.02×1023个原子 |
| B、0.012kg12C约含有6.02×1023个碳原子 |
| C、使用摩尔这一单位时必须指明微粒的种类或名称 |
| D、物质的量是国际单位制中七个基本物理量之一 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com