
| A. | 有化学键被破坏的变化不一定是化学变化 | |
| B. | 金属元素与非金属元素原子间形成的化学键不一定是离子键 | |
| C. | 乙炔分子中,σ键与π键数目之比为1:1 | |
| D. | 金刚石中碳原子采取sp3杂化,12g金刚石中含2mol 碳碳单键 |
分析 A.有化学键被破坏的变化不一定是化学变化,可能是物理变化;
B.金属元素和非金属元素原子间形成的化学键可能是共价键;
C.乙炔分子中,σ键与π键数目之比为3:2;
D.金刚石中碳原子采取sp3杂化,每个C原子平均含有2个共价键.
解答 解:A.有化学键被破坏的变化不一定是化学变化,可能是物理变化,如电解质溶于水时发生的电离,只有化学键断裂没有化学键形成,故A正确;
B.金属元素和非金属元素原子间形成的化学键可能是共价键,如氯化铝等只含共价键,故B正确;
C.乙炔分子结构式为H-C≡C-H,σ键与π键数目之比为3:2,故C错误;
D.金刚石中碳原子采取sp3杂化,每个C原子平均含有2个共价键,所以12g金刚石中含2mol 碳碳单键,故D正确;
故选C.
点评 本题考查化学键及物质结构,为高频考点,侧重考查学生判断及空间想象能力,明确物质构成微粒及微粒之间作用力、物质空间结构是解本题关键,注意D中计算方法,为易错点.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 金刚石>晶体硅>晶体硅>二氧化硅>碳化硅 | |
| B. | 氟化氢>碘化氢>溴化氢>氯化氢 | |
| C. | 氧化镁>氧气>氮气>水 | |
| D. | 铯>铷>钾>钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 莽草酸是一种合成治疗禽流感药物达菲的原料,鞣酸存在于苹果、生石榴等植物中.下列关于这两种有机化合物的说法正确的是( )
莽草酸是一种合成治疗禽流感药物达菲的原料,鞣酸存在于苹果、生石榴等植物中.下列关于这两种有机化合物的说法正确的是( )| A. | 等物质的量的两种物质跟足量的NaOH反应,消耗NaOH的量相等 | |
| B. | 完全燃烧等物质的量的两种物质生成二氧化碳和水的量分别相等 | |
| C. | 一定条件下,两种物质都能发生酯化反应和氧化反应 | |
| D. | 鞣酸分子中,可能在同一平面上的原子最多有14个 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②④ | B. | ②③④⑥ | C. | ①②④⑤ | D. | ①②③④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
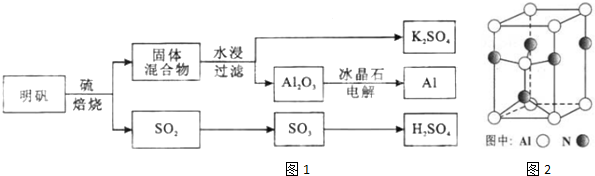
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
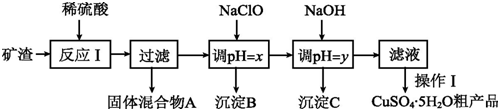
| 沉淀物 | Cu(OH)2 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 |
| 开始沉淀pH | 5.4 | 4.0 | 1.1 | 5.8 |
| 沉淀完全pH | 6.7 | 5.2 | 3.2 | 8.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com