
| A. | 放电时负极反应为:MH+OH--e-═M+H2O | |
| B. | 放电时,每转移1mol电子,有1mol NiOOH被氧化 | |
| C. | 充电时正极反应为:NiOOH+H2O+e-═Ni(OH)2+OH- | |
| D. | 电池电解液可用KOH溶液,充电过程中KOH浓度减小 |
分析 放电时,该装置是原电池,负极上失电子发生氧化反应,正极上得电子发生还原反应,充电时,该装置是电解池,阳极上失电子发生氧化反应,阴极上得电子发生还原反应,根据原电池和电解池的工作原理结合电极反应式和电子转移来回答.
解答 解:A.放电时负极上MH失电子发生氧化反应,电极反应式为MH+OH--e-=M+H2O,故A正确;
B.根据电池在放电过程中的总反应方程式:NiOOH+MH═Ni(OH)2+M知道:该反应转移了1mol电子,即有1 molNiOOH被还原,故B错误;
C、根据电池在放电过程中的总反应方程式:NiOOH+MH═Ni(OH)2+M知道,放电是正极的电极反应式为:NiOOH+H2O+e-═Ni(OH)2+OH-,故C错误;
D、根据电池反应知道:该电池可以在碱性环境下工作,即能用KOH溶液作为电解质溶液,在转移电子相等的情况下负极消耗1mol的氢氧根离子,正极产生1mol的氢氧根离子,所以充放电过程溶液中氢氧根离子的浓度不变,故D错误.
故选A.
点评 本题考查原电池和电解池原理,明确电池反应中元素的化合价变化及工作原理即可解答,注意与氧化还原反应的结合,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 操 作 | 现 象 | 结论 |
| A | 将浓硫酸滴到蔗糖表面 | 固体变黑膨胀 | 浓硫酸只表现脱水性 |
| B | 常温下将Al片放入浓硝酸中 | 无明显现象 | Al与浓硝酸不反应 |
| C | 将一小块Na放入无水乙醇中 | 产生气泡 | Na能置换出醇羟基中的氢 |
| D | 将盐酸滴入Na2CO3溶液中 | 产生气泡 | Cl的非金属性比C强 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
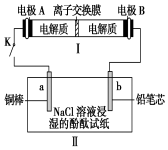 如图所示装置Ⅰ是可充电电池.已知:该充电电池充电时的反应为:
如图所示装置Ⅰ是可充电电池.已知:该充电电池充电时的反应为:| A. | 闭合开关K时,电极B上发生的反应是:Br3-+2e-═3Br- | |
| B. | 闭合开关K时,I中Na+移向A极,II中Na+移向a极 | |
| C. | 当有0.01 mol Na+通过离子交换膜时,b电极上析出标准状况下的气体112 mL | |
| D. | 闭合开关K时,Ⅱ中发生反应的离子方程式为:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$2OH-+H2↑+Cl2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在25℃、1.01×105Pa时,11.2L氮气所含的原子数目为NA | |
| B. | 常温下,1L0.1mol/L的Na2CO3溶液中含有的离子总数为0.3NA | |
| C. | 钠在空气中燃烧可生成多种氧化物,23g钠充分燃烧时转移电子数为1NA | |
| D. | 1molP4和1molCH4中含有的共价健数均为4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向漂白粉溶液中通入适量CO2以增强溶液的漂白性 | |
| B. | 将甲烷和氯气光照后的混合物通过饱和食盐水以获得纯净的一氯甲烷 | |
| C. | 滴定实验前用待测溶液润洗锥形瓶以减小实验误差 | |
| D. | 配制硝酸亚铁溶液时,将硝酸亚铁溶解在稀硝酸中再加水稀释 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
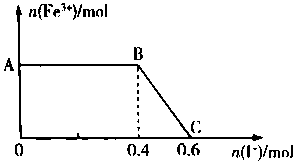 将FeC12溶液与过量氯水(视溶质为Cl2)混合,发生反应:Cl2+ZFeCl2=2FeCl3,得到溶液X.向溶液X中加入KI溶液,混合溶液中Fe3+的物质的量随加入KI的物质的量的变化关系如图所示.已知Cl2、FeCl3均可将I-氧化为I2,其自身分别被还原为Cl-、Fe2+.回答下列问题:
将FeC12溶液与过量氯水(视溶质为Cl2)混合,发生反应:Cl2+ZFeCl2=2FeCl3,得到溶液X.向溶液X中加入KI溶液,混合溶液中Fe3+的物质的量随加入KI的物质的量的变化关系如图所示.已知Cl2、FeCl3均可将I-氧化为I2,其自身分别被还原为Cl-、Fe2+.回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com