
【题目】烯烃在一定条件下可以按下面的框图进行反应:

其中,D是 。F1和F2互为同分异构体,G1和G2互为同分异构体。
。F1和F2互为同分异构体,G1和G2互为同分异构体。
(1)A的结构简式是:____________.
(2)框图中属于取代反应的是(填数字代号):______________.
(3)框图中属于加成反应的是_____________________.
(4)G1的结构简式是:____________________.
【答案】 (CH3)2C=C(CH3)2 ② ①③④⑥⑦⑧ 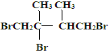
【解析】由D可知A为(CH3)2C=C(CH3)2,则B为(CH3)2CH-CH(CH3)2,由反应③可知C为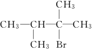 ,D在NaOH醇溶液中加热条件下发生消去反应,E为CH2=C(CH3)-C(CH3)=CH2,CH2=C(CH3)C(CH3)=CH2可与溴发生1,2加成或1,4加成,F1与溴化氢得两种产物,而F2与溴化氢得一种产物,且F1可F2都可生成G1,则F1为CH2BrCBr(CH3)C(CH3)=CH2,F2为CH2BrC(CH3)=C(CH3)CH2Br,G1为
,D在NaOH醇溶液中加热条件下发生消去反应,E为CH2=C(CH3)-C(CH3)=CH2,CH2=C(CH3)C(CH3)=CH2可与溴发生1,2加成或1,4加成,F1与溴化氢得两种产物,而F2与溴化氢得一种产物,且F1可F2都可生成G1,则F1为CH2BrCBr(CH3)C(CH3)=CH2,F2为CH2BrC(CH3)=C(CH3)CH2Br,G1为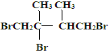 ,G2为CH2BrCBr(CH3)CBr(CH3)CH3;
,G2为CH2BrCBr(CH3)CBr(CH3)CH3;
(1)通过以上分析知,A结构简式为(CH3)2C=C(CH3)2;
(2)反应①为加成反应,②为取代反应,③为加成反应,④为加成反应,⑤为消去反应,⑥为加成反应,⑦为加成反应,⑧为加成反应;
(3)由(2)分析可知框图中属于加成反应有①③④⑥⑦⑧;
(4)G1的结构简式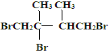 。
。


 小题狂做系列答案
小题狂做系列答案科目:高中化学 来源: 题型:
【题目】我国政府为了消除碘缺乏病,规定在食盐中必须加入适量的碘酸钾。检验食盐中是否加碘,可利用如下反应:
KIO3+ KI+ H2SO4═ K2SO4+ I2 + H2O
(1)配平该方程式,并且用双线桥法表示该方程式电子转移的方向与数目:____________________
(2)该反应中氧化剂和还原剂的物质的量之比为______________;
(3)如果反应中转移0.5mol电子,则生成I2的物质的量为____________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中,错误的是
A. 苯与浓硝酸、浓硫酸共热并保持55~60℃反应生成硝基苯
B. 苯不能使酸性高锰酸钾褪色,说明苯环中没有碳碳双键
C. 甲烷中混有的乙烯可以用溴水除去
D. 医院用75%酒精杀菌、消毒,75%是指质量分数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应A(g)+3B(g)![]() 2C(g)+2D(g),在四种不同情况下用不同物质表示的反应速率分别如下,其中反应速率最大的是( )
2C(g)+2D(g),在四种不同情况下用不同物质表示的反应速率分别如下,其中反应速率最大的是( )
A. v(A)=0.15mol/(Lmin)
B. v(B)=0.04mol/(Ls)
C. v(C)=0.03mol/(Ls)
D. v(D)=0.4mol/(Lmin)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上的许多反应工艺来源于实验室里的简单操作,比如用铝土矿(成分为氧化铝、氧化铁)制取铝的过程如下:
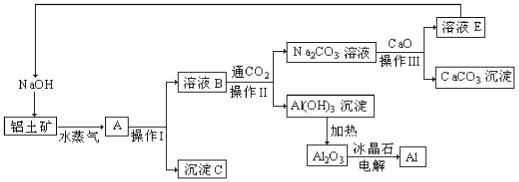
请回答下列问题:
(1)写出铝土矿中加入NaOH溶液的反应方程式_____________。
(2)沉淀C的颜色和一种用途分别为______________________________。
(3)操作I、操作II、操作III都用到的玻璃仪器是有_______________。
(4)整个生产过程中,除可以循环使用的物质有___________________(任意两种,填化学式)。用此法制取铝的副产品是________(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将等体积,等物质的量浓度的NH4HCO3与NaCl溶液混合,析出部分NaHCO3晶体,过滤,所得滤液pH<7。下列关于滤液中的离子浓度关系不正确的是( )
A.  <1.0×10-7mol/L
<1.0×10-7mol/L
B. c(Na+)= c(HCO3-)+ c(CO32-)+ c(H2CO3)
C. c(H+)+c(NH4+)= c(OH-)+ c(HCO3-)+2 c(CO32-)
D. c(Cl-)> c(NH4+)> c(HCO3-)> c(CO32-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫的多种化合物在工业中有重要的应用。
(1)连二亚硫酸钠(Na2S2O4)又称保险粉,是最适合木浆造纸的漂白剂,其水溶液性质不稳定,有极强的还原性。
①Na2S2O4中S元素的化合价为__________。
②Na2S2O4暴露于空气中易吸收氧气和水蒸气而变质,发生反应时,当氧化剂和还原剂的物质的量之比为l:2时,产物为___________(填化学式)。
③将甲酸和NaOH溶液混合,再通入SO2气体,会得到保险粉,此时甲酸被氧化为CO2。该反应的化学方程式为____________________。
(2)铬会造成环境污染.某酸性废水中含有Cr2O72-,处理时可用焦亚硫酸钠(Na2S2O5)将Cr2O72-转化为毒性较低的Cr3+,再调节pH至8,使铬元素沉降,分离出污泥后测得废水中Cr3+浓度为0.52mg·L-1,达到排放标准。
①Na2S2O5参加反应的离子方程式为____________。
②处理后的废水中Cr3+的物质的量浓度为__________mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组探究SO2气体还原Fe3+、I2,他们使用的药品和装置如下图所示。

(1)装置C的作用是___________________________。
(2)①设计实验方案检验有Fe2+生成:______________________________________________。
②证明SO2气体还原I2的现象:_______________________________________________________________。
(3)若要从A中所得溶液提取晶体,必须进行的实验操作步骤为蒸发浓缩、冷却结晶、过滤、自然干燥,在这一系列操作中没有用到的仪器有________(填字母)。
A.蒸发皿 B.试管夹C.漏斗 D.烧杯 E.玻璃棒 F.坩埚
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com