
ΓΨΧβΡΩΓΩΫΪEΚΆFΦ”»κΟή±’»ίΤς÷–Θ§‘Ύ“ΜΕ®ΧθΦΰœ¬ΖΔ…ζΖ¥”ΠΘΚE(g)ΘΪF(s) ![]() 2G(g)ΓΘΤΫΚβ ±GΒΡΧεΜΐΖ÷ ΐ(%)ΥφΈ¬Ε»ΚΆ―Ι«ΩΒΡ±δΜ·»γœ¬±μΥυ ΨΘΚ
2G(g)ΓΘΤΫΚβ ±GΒΡΧεΜΐΖ÷ ΐ(%)ΥφΈ¬Ε»ΚΆ―Ι«ΩΒΡ±δΜ·»γœ¬±μΥυ ΨΘΚ
Έ¬Ε»/ΧεΜΐΖ÷ ΐ/―Ι«Ω | 1.0 | 2.0 | 3.0 |
810 | 54.0 | a | B |
915 | c | 75.0 | D |
1000 | E | f | 83.0 |
ΔΌbΘΦf ΔΎ915 ΓφΓΔ2.0 MPa ±EΒΡΉΣΜ·¬ ΈΣ60% ΔέΗΟΖ¥”ΠΒΡΠΛSΘΨ0 ΔήK(1 000 Γφ)ΘΨK(810 Γφ) …œ ωΔΌΓΪΔή÷–’ΐ»ΖΒΡ (ΓΓΓΓ)
A.ΔΌΔΎB.ΔΎΔέC.ΔΎΔέΔήD.ΔΌΔΎΔέΔή
ΓΨ¥πΑΗΓΩD
ΓΨΫβΈωΓΩ
ΔΌΗυΨί±μ÷– ΐΨίΖ÷ΈωΘ§a”κbΓΔc”κdΓΔe”κf÷°Φδ «―Ι«ΩΈ ΧβΘ§ΥφΉ≈―Ι«Ω‘ω¥σΘ§ΤΫΚβΡφœρ“ΤΕ·Θ§GΒΡΧεΜΐΖ÷ ΐΦθ–ΓΘ§Υυ“‘”–b<aΘ§c>75.0%Θ§e>83%ΓΘfΒΡΈ¬Ε»±»bΗΏΘ§―Ι«Ω±»b–ΓΘ§Υυ“‘f>bΘ§Υυ“‘ΔΌ’ΐ»ΖΘΜ
ΔΎ…ηEΒΡΤπ ΦΝΩΈΣ1molΘ§ΉΣΜ·ΒΡEΈΣxΘ§‘ρΤΫΚβ ±GΒΡΝΩΈΣ2xmolΘ§‘ρ”…Χβ“βΒΟΒΫ
E(g)ΘΪF(s) ![]() 2G(g)
2G(g)
Τπ Φ(mol)ΘΚ1 0
±δΜ·(mol)ΘΚx 2x
ΤΫΚβ(mol)ΘΚ1- x 2x
![]() ΓΝ100%=75%Θ§ΫβΒΟx=0.6
ΓΝ100%=75%Θ§ΫβΒΟx=0.6
915 ΓφΓΔ2.0 MPa ±EΒΡΉΣΜ·¬ ΈΣ![]() =60% Ι ΔΎ’ΐ»ΖΘΜ
=60% Ι ΔΎ’ΐ»ΖΘΜ
ΔέΗΟΖ¥”Π ±“ΜΗωΤχΧεΖ÷Ή”‘ω¥σΒΡΖ¥”ΠΘ§ τ”ΎλΊ‘ωΒΡΖ¥”ΠΘ§Ι ΗΟΖ¥”ΠΒΡΓςS>0Θ§Ι Δέ’ΐ»ΖΘΜ
Δήάϊ”Οc>75.0%>54.0%Θ§Ω…÷ΣΆ§―Ιœ¬Θ§…ΐΈ¬ΤΫΚβ’ΐœρ“ΤΕ·Θ§Φ¥’ΐΖ¥”ΠΈΣΈϋ»»Ζ¥”ΠΘ§‘ρΈ¬Ε»‘ΫΗΏΘ§ΤΫΚβ≥Θ ΐ‘Ϋ¥σΘ§Υυ“‘Δή’ΐ»ΖΘΜ
¥πΑΗ―ΓDΓΘ
.



| ΡξΦΕ | ΗΏ÷–ΩΈ≥Χ | ΡξΦΕ | ≥θ÷–ΩΈ≥Χ |
| ΗΏ“Μ | ΗΏ“ΜΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ | ≥θ“Μ | ≥θ“ΜΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ |
| ΗΏΕΰ | ΗΏΕΰΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ | ≥θΕΰ | ≥θΕΰΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ |
| ΗΏ»ΐ | ΗΏ»ΐΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ | ≥θ»ΐ | ≥θ»ΐΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ |
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩΖ¥”Π4AΘ®gΘ©+5BΘ®gΘ©![]() 4CΘ®gΘ©+6DΘ®gΘ©Θ§‘Ύ5 LΒΡΟή±’»ίΤς÷–Ϋχ––Θ§ΑκΖ÷÷”ΚσΘ§CΒΡΈο÷ ΒΡΝΩ‘ωΦ”ΝΥ0.30 molΓΘœ¬Ν––π ω’ΐ»ΖΒΡ «Θ®ΓΓΓΓΘ©
4CΘ®gΘ©+6DΘ®gΘ©Θ§‘Ύ5 LΒΡΟή±’»ίΤς÷–Ϋχ––Θ§ΑκΖ÷÷”ΚσΘ§CΒΡΈο÷ ΒΡΝΩ‘ωΦ”ΝΥ0.30 molΓΘœ¬Ν––π ω’ΐ»ΖΒΡ «Θ®ΓΓΓΓΘ©
A. AΒΡΤΫΨυΖ¥”ΠΥΌ¬ «0.010 molL©¹1s©¹1
B. »ίΤς÷–Κ§DΈο÷ ΒΡΝΩ÷Ν…ΌΈΣ0.45 mol
C. »ίΤς÷–AΓΔBΓΔCΓΔDΒΡΈο÷ ΒΡΝΩΒΡ±»“ΜΕ® «4ΓΟ5ΓΟ4ΓΟ6
D. »ίΤς÷–AΒΡΈο÷ ΒΡΝΩ“ΜΕ®‘ωΦ”ΝΥ0.30 mol
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩœ¬Ν–ΥΒΖ®≤Μ’ΐ»ΖΒΡ «Θ® Θ©
A.‘Ύ”ΟΦρ“ΉΝΩ»»ΦΤ≤βΕ®Ζ¥”Π»» ±Θ§Ω… Ι”ΟΥι≈ίΡ≠ΤπΗτ»»±ΘΈ¬ΒΡΉς”ΟΓΔΤ’Ά®≤ΘΝßΑτΫχ––ΫΝΑη ΙΥαΚΆΦν≥δΖ÷Ζ¥”ΠΓΔΉΦ»ΖΕΝ»Γ Β―ι ±Έ¬Ε»ΦΤΉνΗΏΈ¬Ε»ΓΔ≤Δ«“»Γ![]() ¥ΈΒΡ Β―ιΤΫΨυ÷ΒΒ»¥κ ©Θ§“‘¥οΒΫΝΦΚΟΒΡ Β―ι–ßΙϊ
¥ΈΒΡ Β―ιΤΫΨυ÷ΒΒ»¥κ ©Θ§“‘¥οΒΫΝΦΚΟΒΡ Β―ι–ßΙϊ
B.»ίΝΩΤΩΓΔΝΩΆ≤ΚΆΒΈΕ®Ιή…œΕΦ±ξ”– Ι”ΟΈ¬Ε»ΘΜΝΩΆ≤ΓΔ»ίΝΩΤΩΈόΓΑ0Γ±ΩΧΕ»Θ§ΒΈΕ®Ιή”–ΓΑ0Γ±ΩΧΕ»ΘΜ Ι”Ο ±ΒΈΕ®ΙήΥ°œ¥ΚσΜΙ–η»σœ¥Θ§ΒΪ»ίΝΩΤΩΥ°œ¥Κσ≤Μ”Ο»σœ¥
C.pHΦΤΡή”Ο”ΎΥαΦν÷–ΚΆΒΈΕ®÷’ΒψΒΡ≈–Εœ
D.‘Ύ![]() ΒΡ
ΒΡ![]() »ή“Κ÷–ΒΈΦ” ΐΒΈ
»ή“Κ÷–ΒΈΦ” ΐΒΈ![]() ΒΡNaOH»ή“ΚΘ§»ή“Κ―’…Ϊ¥”≥»…Ϊ±δ≥…ΜΤ…Ϊ
ΒΡNaOH»ή“ΚΘ§»ή“Κ―’…Ϊ¥”≥»…Ϊ±δ≥…ΜΤ…Ϊ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩ298K ±Θ§Κœ≥…Α±Ζ¥”ΠΒΡ»»Μ·―ßΖΫ≥Χ ΫΈΣΘΚ
N2(g)+3H2(g)![]() 2NH3(g)ΘΜΓςHΘΫΘ≠92.4kJΓΛmolΘ≠1
2NH3(g)ΘΜΓςHΘΫΘ≠92.4kJΓΛmolΘ≠1
‘ΎΗΟΈ¬Ε»œ¬Θ§»Γ1molN2ΚΆ3molH2Ζ≈‘Ύ“ΜΟή±’»ίΤς÷–Θ§‘Ύ¥ΏΜ·ΦΝ¥φ‘Ύ ±Ϋχ––Ζ¥”ΠΘ§≤βΒΟΖ¥”ΠΖ≈≥ωΒΡ»»ΝΩΉή «–Γ”Ύ92.4 kJ «______________________________________________ΓΘ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩΡ≥Μ·―ß–Υ»Λ–ΓΉιΒΡΦΉΓΔ““ΝΫΈΜΆ§―ßΕ‘≤βΕ®Μ·―ßΖ¥”ΠΥΌ¬ Ζ«≥ΘΗ––Υ»ΛΘ§ΈΣ¥ΥΫχ––ΝΥ”–ΙΊΒΡ Β―ιΧΫΨΩΘ§ Β―ιΦ«¬Φ»γœ¬ΓΘ
[ Β―ιΡΩΒΡ]ΓΓ≤βΝΩ–ΩΚΆœΓΝρΥαΖ¥”ΠΒΡΥΌ¬ ΓΘ
[ Β―ι”ΟΤΖ]ΓΓΉΕ–ΈΤΩΓΔΥΪΩΉ»ϊΓΔΖ÷“Κ¬©ΕΖΓΔ÷±Ϋ«ΒΦΙήΓΔ50 mLΉΔ…δΤςΓΔΧζΦήΧ®ΓΔΟκ±μΓΔ–ΩΝΘΓΔ1 molΓΛLΘ≠1ΒΡH2SO4ΓΔ4 molΓΛLΘ≠1ΒΡH2SO4ΓΘ
[ Β―ι≤Ϋ÷η]
Θ®1Θ©ΦΉΆ§―ß»Γ“ΜΧΉ»γΆΦΉΑ÷ΟΘ§Φ”»κ40 mL 1 molΓΛLΘ≠1ΒΡH2SO4Θ§≤βΝΩ ’Φ·10 mL H2Υυ–ηΒΡ ±ΦδΓΘ

Θ®2Θ©““Ά§―ß»ΓΝμ“ΜΧΉΆ§―υΒΡΉΑ÷ΟΘ§Φ”»κ40 mL 4 molΓΛLΘ≠1ΒΡH2SO4Θ§≤βΝΩ ’Φ·10 mL H2Υυ–ηΒΡ ±ΦδΓΘ
ΜΊ¥πœ¬Ν–Έ ΧβΘΚ
Θ®1Θ©Zn”κœΓH2SO4Ζ¥”ΠΒΡάκΉ”ΖΫ≥Χ ΫΈΣ________ΓΘ
Θ®2Θ© ’Φ·10 mL H2Υυ–η ±ΦδΘΚΦΉ________Θ®ΧνΓΑ¥σ”ΎΓ±ΓΑ–Γ”ΎΓ±ΜρΓΑΒ»”ΎΓ±Θ©““ΓΘΖ¥”ΠΥΌ¬ ΘΚΦΉ________Θ®ΧνΓΑ¥σ”ΎΓ±ΓΑ–Γ”ΎΓ±ΜρΓΑΒ»”ΎΓ±Θ©““ΓΘ
Θ®3Θ©œ¬Ν–ΥΒΖ®’ΐ»ΖΒΡ «________Θ®ΧνΉ÷ΡΗΘ©ΓΘ
A ±Ψ Β―ι÷–ΦΉΓΔ““ΝΫΆ§―ßΥυ”Ο–ΩΝΘΒΡ±μΟφΜΐ“ΣœύΆ§
B ΉΑ÷ΟΤχΟή–‘“ΣΚΟ
C 40 mLΒΡH2SO4“Σ―ΗΥΌΦ”»κ
D ≤βΝΩΤχΧεΧεΜΐΜΙΩ…“‘”Ο≈≈Υ°Ζ®
E »τ”Ο98%ΒΡ≈®H2SO4Θ§‘ρΖ¥”ΠΉνΩλ
Θ®4Θ©≤βΕ®ZnΚΆœΓH2SO4Ζ¥”ΠΒΡΥΌ¬ ΜΙΩ…”ΟΒΡΖΫΖ®”–ΘΚΔΌ___________ΘΜΓΓΔΎ_________ΓΘ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩΈΣ Βœ÷œ¬Ν– Β―ιΡΩΒΡΘ§œ¬±μΧαΙ©ΒΡ÷ς“Σ“«Τς“‘ΦΑΥυ”Ο ‘ΦΝΨυΚœάμΒΡ «Θ® Θ©
―Γœν | Β―ιΡΩΒΡ | ÷ς“Σ“«Τς | ‘ΦΝ |
A | ≈δ÷Τ480mL | ΫΚΆΖΒΈΙήΓΔ…’±≠ΓΔ≤ΘΝßΑτΓΔΆ–≈ΧΧλΤΫΓΔ480mL»ίΝΩΤΩ | NaOHΙΧΧεΓΔ’τΝσΥ° |
B | Ζ÷άκ | Ζ÷“Κ¬©ΕΖΓΔ…’±≠ | ““¥Φ |
C | Φχ±π | ‘ΙήΓΔΫΚΆΖΒΈΙή | ≥Έ«ε ·Μ“Υ° |
D | Φχ±πΤœΧ―Χ«ΚΆ’αΧ« | ‘ΙήΓΔ…’±≠ΓΔΨΤΨΪΒΤ | ΤœΧ―Χ«»ή“ΚΓΔ’αΧ«»ή“ΚΓΔ“χΑ±»ή“Κ |
A.AB.BC.CD.D
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩ‘ΎΚψ»ίΟή±’»ίΤς÷–¥φ‘Ύ»γœ¬Ζ¥”ΠΓΘ2A(g)+B(g)![]() 3C(g)+D(s) HΘΦ0Θ§‘ΎΤδΥϊΧθΦΰ≤Μ±δ ±Θ§ΗΡ±δΡ≥“ΜΧθΦΰΕ‘…œ ωΤΫΚβΒΡ”ΑœλΘ§œ¬Ν–Ζ÷Έω’ΐ»ΖΒΡ «( )
3C(g)+D(s) HΘΦ0Θ§‘ΎΤδΥϊΧθΦΰ≤Μ±δ ±Θ§ΗΡ±δΡ≥“ΜΧθΦΰΕ‘…œ ωΤΫΚβΒΡ”ΑœλΘ§œ¬Ν–Ζ÷Έω’ΐ»ΖΒΡ «( )
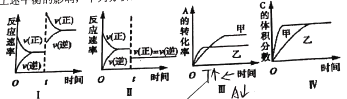
A.ΆΦΔώ±μ Ψ‘ωΦ”…ζ≥…Έο≈®Ε»Ε‘ΗΟΤΫΚβΒΡ”Αœλ
B.ΆΦΔρ±μ Ψ‘ω¥σ―Ι«ΩΕ‘ΗΟΤΫΚβΒΡ”Αœλ
C.ΆΦΔσ±μ ΨΈ¬Ε»Ε‘ΗΟΤΫΚβΒΡ”ΑœλΘ§Έ¬Ε»ΘΚ““>ΦΉ
D.ΆΦΔτ±μ Ψ¥ΏΜ·ΦΝΕ‘ΗΟΤΫΚβΒΡ”ΑœλΘ§¥ΏΜ·–߬ ΘΚ““>ΦΉ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩΒΰΒΣΥα(HN3)”κ¥ΉΥαΒΡΥα–‘œύΥΤ,0.2 mol HN3”κ0.2 mol NaOHΖ¥”ΠΚσΫΪ»ή“ΚœΓ Ά÷Ν500 mL,≤βΒΟ»ή“ΚpH=a,œ¬Ν–ΥΒΖ®“ΜΕ®¥μΈσΒΡ «(ΓΓΓΓ)
A.HN3Υ°»ή“Κ÷–ΈΔΝΘ≈®Ε»¥σ–ΓΥ≥–ρΈΣc(HN3)>c(H+)>c(N3ΓΣ)>c(OH-)
B.Χβ Ψ500 mL»ή“Κ÷–άκΉ”≈®Ε»¥σ–ΓΥ≥–ρΈΣc(Na+)>c(N3ΓΣ)>c(OH-)>c(H+)
C.Χβ Ψ500 mL»ή“Κ÷–”…Υ°Βγάκ≤ζ…ζΒΡc(OH-)=1ΓΝ10-amolΓΛL-1
D.ΗυΨίΧβΗχ ΐΨίΩ…“‘ΦΤΥψΗΟΈ¬Ε»œ¬ΒΰΒΣΥαΒΡΒγάκΤΫΚβ≥Θ ΐKa
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩNA «ΑΔΖϋΦ”Β¬¬ό≥Θ ΐΒΡ÷ΒΘ§œ¬Ν–ΥΒΖ®≤Μ’ΐ»ΖΒΡ «
A.5.5g≥§÷ΊΥ°(T2O)÷–Κ§”–ΒΡ÷–Ή” ΐΡΩΈΣ3NA
B.≥ΘΈ¬≥Θ―Ιœ¬Θ§44gCO2”κΉψΝΩΙΐ―θΜ·ΡΤΖ¥”ΠΉΣ“ΤΒγΉ”ΒΡ ΐΡΩΈΣNA
C.≥ΘΈ¬≥Θ―Ιœ¬Θ§42gC2H4ΚΆC4H8ΜλΚœΤχΧε÷–Κ§”–«β‘≠Ή”ΒΡ ΐΡΩΈΣ6NA
D.0.1L0.5molΓΛLΘ≠1CH3COOH»ή“Κ÷–Κ§”–HΘΪ ΐΡΩΈΣ0.2NA
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΑΌΕ»÷¬–≈ - ΝΖœΑ≤αΝ–±μ - ‘ΧβΝ–±μ
Κΰ±± ΓΜΞΝΣΆχΈΞΖ®ΚΆ≤ΜΝΦ–≈œΔΨΌ±®ΤΫΧ® | Άχ…œ”–ΚΠ–≈œΔΨΌ±®Ή®«χ | Βγ–≈’©Τ≠ΨΌ±®Ή®«χ | …φάζ Ζ–ιΈό÷ς“ε”–ΚΠ–≈œΔΨΌ±®Ή®«χ | …φΤσ«÷»®ΨΌ±®Ή®«χ
ΈΞΖ®ΚΆ≤ΜΝΦ–≈œΔΨΌ±®ΒγΜΑΘΚ027-86699610 ΨΌ±®” œδΘΚ58377363@163.com