
分析 影响化学反应速率的因素有温度、浓度、压强、催化剂等,从改变外界条件对活化分子的浓度或百分数的影响角度分析化学反应速率的变化.
解答 解:(1)升高温度,活化分子的百分数增大,反应速率增大,故答案为:增大;
(2)容器体积不变,充入惰性气体,参与反应的气体浓度不变,反应速率不变,故答案为:不变;
(3)增大容器容积,浓度减小,反应速率减小,故答案为:减小;
(4)等压充入惰性气体,参与反应的气体浓度减小,反应速率减小,故答案为:减小;
(5)Y为固体,加入Y对反应速率无影响,故答案为:不变;
(6)压缩体积,压强增大,反应物的浓度增大,活化分子浓度增大,反应速率增大,故答案为:增大.
点评 本题考查外界条件对反应速率的影响,题目难度不大,注意外界条件对活化分子的影响,注重基础知识的积累.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | ①中X2+是氧化产物 | B. | 还原性强弱的顺序为:Z->A2+ | ||
| C. | 氧化性强弱的顺序为:XO4->B2 | D. | 溶液中可发生:Z2+2A2+=2A3++2Z- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
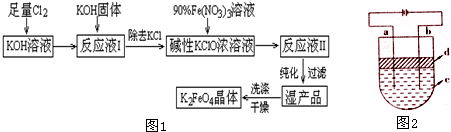
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
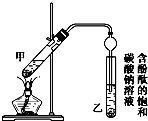 已知下列数据:
已知下列数据:| 物质 | 熔点(℃) | 沸点(℃) | 密度(g•cm-3) |
| 乙醇 | -117.0 | 78.0 | 0.79 |
| 乙酸 | 16.6 | 117.9 | 1.05 |
| 乙酸乙酯 | -83.6 | 77.5 | 0.90 |
| 实验 | 乙醇(mL) | 乙酸(mL) | 乙酸乙酯(mL) |
| ① | 2 | 2 | 1.33 |
| ② | 3 | 2 | 1.57 |
| ③ | 4 | 2 | x |
| ④ | 5 | 2 | 1.76 |
| ⑤ | 2 | 3 | 1.55 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com