
 通城学典默写能手系列答案
通城学典默写能手系列答案科目:高中化学 来源: 题型:
(15分)铁及其化合物在生活、生产中有广泛应用。请回答下列问题:
(1)Fe是人体不可缺少的微量元素,摄入含铁化合物可补充铁。正常人每天应补充14mg左右的铁。其中绝大部分来自于食物。如果全部通过服用含FeSO4·7H2O的片剂来补充铁,则正常人每天服需用含 mg FeSO4·7H2O的片剂。
(2)某同学为了检验家中的一瓶补铁药(成分为FeSO4)是否变质,查阅了有关资料,得知Fe2+能被酸性高锰酸钾溶液氧化而使高锰酸钾溶液褪色,并结合已学的知识设计了如下实验:将药片除去糖衣研细后,溶解过滤,取滤液分别加入两支试管中,在一支试管中滴入酸性高锰酸钾溶液,在另一支试管中滴入KSCN溶液。该同学观察到的现象是:滴入酸性高锰酸钾溶液后褪色,滴入KSCN溶液后不变红,据此得出的结论是 。
(3)黄铁矿(FeS2)是生产硫酸和冶炼钢铁的重要原料。其中一个反应为
3FeS2+8O26SO2+Fe3O4,若有3 mol FeS2参加反应,则转移 mol电子。
(4)氯化铁溶液常用作印刷电路铜板腐蚀剂,反应的离子方程式为 ;
(5)与明矾相似,硫酸铁也可用作净水剂,在使用时发现硫酸铁并不能使酸性废水中的悬浮物沉降除去,其原因是 。
查看答案和解析>>
科目:高中化学 来源:2010年沙河一中考前预测卷化学试题 题型:填空题
(12分)铁及其化合物在生活、生产中有广泛应用。请回答下列问题:
(1)黄铁矿(FeS2)是生产硫酸和冶炼钢铁的重要原料。其中一个反应为
3FeS2+8O2 6SO2+Fe3O4,氧化产物为 ,若有3 mol FeS2参加反应,转移 mol电子。
6SO2+Fe3O4,氧化产物为 ,若有3 mol FeS2参加反应,转移 mol电子。
(2)氯化铁溶液常用作印刷电路铜板腐蚀剂,反应的离子方程式为
。
(3)与明矾相似,硫酸铁也可用作净水剂,其原理为 (用离子方程表示)
(4)①钢铁的电化腐蚀简单示意图如下,将该图稍作修改即可成为钢铁电化学防护的简单示意图,请在下图虚线框内作出修改,并用箭头标出电子流动方向。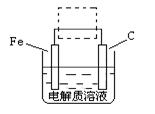
②写出修改前的钢铁吸氧腐蚀石墨电极的电极反应式 。
(5)铁红是一种红色颜料,其成分是Fe2O.3将一定量的铁红溶于160ml5 mol·L—1盐酸中,在加入一定量铁粉恰好溶解,收集到2.24L(标准状况),经检测,溶夜中无Fe3+,则参加反应的铁粉的质量为 。
查看答案和解析>>
科目:高中化学 来源:2010年广东省龙川一中高三8月月考(理综)化学部分 题型:填空题
(15分)铁及其化合物在生活、生产中有广泛应用。请回答下列问题:
(1)Fe是人体不可缺少的微量元素,摄入含铁化合物可补充铁。正常人每天应补充14mg左右的铁。其中绝大部分来自于食物。如果全部通过服用含FeSO4·7H2O的片剂来补充铁,则正常人每天服需用含 mg FeSO4·7H2O的片剂。
(2)某同学为了检验家中的一瓶补铁药(成分为FeSO4)是否变质,查阅了有关资料,得知Fe2+能被酸性高锰酸钾溶液氧化而使高锰酸钾溶液褪色,并结合已学的知识设计了如下实验:将药片除去糖衣研细后,溶解过滤,取滤液分别加入两支试管中,在一支试管中滴入酸性高锰酸钾溶液,在另一支试管中滴入KSCN溶液。该同学观察到的现象是:滴入酸性高锰酸钾溶液后褪色,滴入KSCN溶液后不变红,据此得出的结论是 。
(3)黄铁矿(FeS2)是生产硫酸和冶炼钢铁的重要原料。其中一个反应为
3FeS2+8O2 6SO2+Fe3O4,若有3 mol FeS2参加反应,则转移 mol电子。
6SO2+Fe3O4,若有3 mol FeS2参加反应,则转移 mol电子。
(4)氯化铁溶液常用作印刷电路铜板腐蚀剂,反应的离子方程式为 ;
(5)与明矾相似,硫酸铁也可用作净水剂,在使用时发现硫酸铁并不能使酸性废水中的悬浮物沉降除去,其原因是 。
查看答案和解析>>
科目:高中化学 来源:2013届江西省安福中学高三第二次段考理科综合化学试卷(带解析) 题型:填空题
(16分)铁及其化合物在生活、生产中有广泛应用。请回答下列问题:
(1)黄铁矿(FeS2)是生产硫酸和冶炼钢铁的重要原料。其中一个反应为
3FeS2+8O2 ==6SO2+Fe3O4,氧化产物为 ,若有3 mol FeS2参加反应,
==6SO2+Fe3O4,氧化产物为 ,若有3 mol FeS2参加反应,
转移 mol电子。
(2)氯化铁溶液常用作印刷电路铜板腐蚀剂,反应的离子方程式为 。
(3)与明矾相似,硫酸铁也可用作净水剂,其原理为 (用离子方程表示)
(4)①钢铁的电化腐蚀简单示意图如右,将该图稍作修改即可成为钢铁电化学防护的简单示意图,请在下图虚线框内作出修改,并用箭头标出电子流动方向。
②写出修改前的钢铁吸氧腐蚀石墨电极的电极反应式 。
(5)铁红是一种红色颜料,其成分是Fe2O.3将一定量的铁红溶于160ml5 mol·L—1盐酸中,在加入一定量铁粉恰好溶解,收集到2.24L(标准状况),经检测,溶夜中无Fe3+,则参加反应的铁粉的质量为 。
查看答案和解析>>
科目:高中化学 来源:2010年广东省高三8月月考(理综)化学部分 题型:填空题
(15分)铁及其化合物在生活、生产中有广泛应用。请回答下列问题:
(1)Fe是人体不可缺少的微量元素,摄入含铁化合物可补充铁。正常人每天应补充14mg左右的铁。其中绝大部分来自于食物。如果全部通过服用含FeSO4·7H2O的片剂来补充铁,则正常人每天服需用含 mg FeSO4·7H2O的片剂。
(2)某同学为了检验家中的一瓶补铁药(成分为FeSO4)是否变质,查阅了有关资料,得知Fe2+能被酸性高锰酸钾溶液氧化而使高锰酸钾溶液褪色,并结合已学的知识设计了如下实验:将药片除去糖衣研细后,溶解过滤,取滤液分别加入两支试管中,在一支试管中滴入酸性高锰酸钾溶液,在另一支试管中滴入KSCN溶液。该同学观察到的现象是:滴入酸性高锰酸钾溶液后褪色,滴入KSCN溶液后不变红,据此得出的结论是 。
(3)黄铁矿(FeS2)是生产硫酸和冶炼钢铁的重要原料。其中一个反应为
3FeS2+8O2 6SO2+Fe3O4,若有3 mol FeS2参加反应,则转移 mol电子。
6SO2+Fe3O4,若有3 mol FeS2参加反应,则转移 mol电子。
(4)氯化铁溶液常用作印刷电路铜板腐蚀剂,反应的离子方程式为 ;
(5)与明矾相似,硫酸铁也可用作净水剂,在使用时发现硫酸铁并不能使酸性废水中的悬浮物沉降除去,其原因是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com