
| A. | 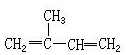 2-甲基-1,3-丁二烯 2-甲基-1,3-丁二烯 | B. | 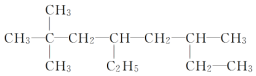 2,2-二甲基-4,6-二乙基庚烷 2,2-二甲基-4,6-二乙基庚烷 | ||
| C. |  1,3,4-三甲苯 1,3,4-三甲苯 | D. |  2-甲基-3-戊烯 2-甲基-3-戊烯 |
分析 判断有机物的命名是否正确或对有机物进行命名,其核心是准确理解命名规范:
(1)烷烃命名原则:
①长:选最长碳链为主链;
②多:遇等长碳链时,支链最多为主链;
③近:离支链最近一端编号;
④小:支链编号之和最小.看下面结构简式,从右端或左端看,均符合“近-----离支链最近一端编号”的原则;
⑤简:两取代基距离主链两端等距离时,从简单取代基开始编号.如取代基不同,就把简单的写在前面,复杂的写在后面;
(2)有机物的名称书写要规范;
(3)对于结构中含有苯环的,命名时可以依次编号命名,也可以根据其相对位置,用“邻”、“间”、“对”进行命名;
(4)含有官能团的有机物命名时,要选含官能团的最长碳链作为主链,官能团的位次最小.
解答 解:A.选取含碳碳双键在内的最长碳链为主碳链,离双键近的一端编号,得到名称2-甲基-1,3-丁二烯,故A正确;
B.选取最长碳链为主碳链有8个碳原子,离取代基近的一端编号确定取代基位置,得到名称为2,2,6-三甲基-4-乙基辛烷,故B错误;
C.选取位次和最小的甲基为起点,名称为1,2,4-三甲苯,故C错误;
D.选取含碳碳双键在内的最长碳链为主碳链,离双键近的一端编号,名称为4-甲基-2-戊烯,故D错误;
故选A.
点评 本题考查有机物的命名判断,题目难度中等,该题侧重对学生基础知识的检验和训练,关键是明确有机物的命名原则,然后结合有机物的结构简式灵活运用即可,有利于培养学生的规范答题能力及灵活应用所学知识的能力.


科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2具有氧化性,可用于漂白纸浆 | |
| B. | 氢氟酸具有酸性,可用于雕刻玻璃 | |
| C. | 二氧化氯具有还原性,可用于自来水的杀菌消毒 | |
| D. | NH3具有还原性,可用NH3与灼热CuO作用制取少量N2 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的氢氧化钠溶液时,选择酚酞作指示剂.请填写下列空白:
某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的氢氧化钠溶液时,选择酚酞作指示剂.请填写下列空白:| 滴定 次数 | 待测氢氧化钠溶 液的体积/mL | 0.1000mol•L+1盐酸的体积(mL) | |
| 滴定前刻度 | 滴定后刻度 | ||
| 第一次 | 25.00 | 0.00 | 26.11 |
| 第二次 | 25.00 | 1.56 | 30.30 |
| 第三次 | 25.00 | 0.22 | 26.31 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度/℃ | 200 | 300 | 400 |
| K | 1.0 | 0.85 | 0.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 煤、石油、天然气均为混合物,煤中含有苯等有机物 | |
| B. | 石油裂化和煤的干馏都是化学变化,而石油的分馏和煤的气化都是物理变化 | |
| C. | 石油的裂解主要目的是提高汽油的产量和质量 | |
| D. | 汽油燃烧产生的汽车尾气中,所含的大气污染物主要是碳氮的氧化物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com