
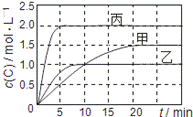
向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:xA(g)+B(g) 2C(g)。各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别用下表和下图表示:
2C(g)。各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别用下表和下图表示:
| 容器 | 甲 | 乙 | 丙 |
| 容积 | 1L | 1L | 2L |
| 温度 | T1 | T2 | T2 |
| 反应物 起始量 | 1molA 2molB | 1molA 2molB | 4molA 8molB |
下列说法正确的是
A.由图可知:T1<T2,且该反应为吸热反应 B.T1时该反应的平衡常数K=7.2
C.前10min甲、乙、丙三个容器中A的反应速率:v(A)甲=v(A)乙<v(A)丙
D.平衡时A的质量m:m乙<m甲<m丙
 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案科目:高中化学 来源: 题型:
已知分解1 mol H2O2 放出热量98KJ,在含少量I-的溶液中,H2O2的分解机理为:
H2O2+ I- →H2O +IO- 慢 H2O2+ IO-→H2O +O2+ I- 快
下列有关反应的说法正确的是( )
A.反应的速率与I-的浓度有关 B. IO-也是该反应的催化剂
C.反应活化能等于98KJ·mol-1 D.v(H2O2)=v(H2O)=v(O2)
查看答案和解析>>
科目:高中化学 来源: 题型:
FeCl3、CuCl2的混合溶液中加入铁粉,充分反应后仍有固体存在,则下列判断不正确的是( )
|
| A. | 加入KSCN溶液一定不变红色 | B. | 溶液中一定含Fe2+ |
|
| C. | 溶液中一定不含Cu2+ | D. | 剩余固体中一定含Cu |
查看答案和解析>>
科目:高中化学 来源: 题型:
化学科学需要借助化学专用语言描述,下列有关化学用语正确的是
A.HClO的结构式:H-O-Cl B.Na2O2的电子式: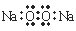
C.中子数为20的氯原子: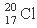 D.聚丙烯的结构简式:
D.聚丙烯的结构简式: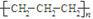
查看答案和解析>>
科目:高中化学 来源: 题型:
下列依据相关实验得出的结论正确的是
A.利用一束强光照射明矾溶液,产生光亮的“通路”,说明明矾一定发生了水解
B.向盛有Fe(NO3)2溶液的试管中加入0.1 mol·L-1 H2SO4溶液,试管口出现红棕色气体, 说明溶液中NO 被Fe2+还原为NO2
被Fe2+还原为NO2
C.将某气体通入品红溶液中,品红褪色,说明该气体一定是SO2
D.向淀粉溶液中加入稀H2SO4,加热几分钟,冷却后再加入新制Cu(OH)2悬浊液,加热,无砖红色沉淀生成,说明淀粉没有水解生成葡萄糖
查看答案和解析>>
科目:高中化学 来源: 题型:
平板电视显示屏生产过程中产生大量的废玻璃粉末(含SiO2、Fe2O3、CeO2、FeO等物质)。某课题小组以此粉末为原料,设计如下工艺流程对资源进行回收,得到Ce(OH)4和硫酸铁铵矾:
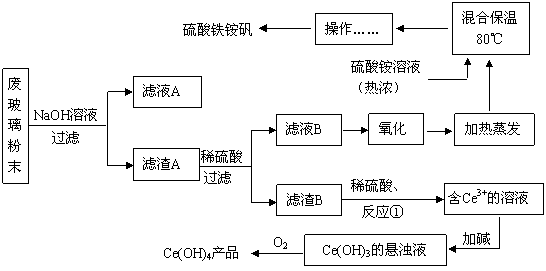
已知:
Ⅰ.酸性条件下,铈在水溶液中有Ce3+、Ce4+两种主要存在形式,Ce3+易水解,Ce4+有较强氧化性;
Ⅱ.CeO2不溶于稀硫酸;
Ⅲ.硫酸铁铵矾[Fe2(SO4) 3·(NH4) 2SO4·24H2O]广泛用于水的净化处理。
(1)滤液A的主要成分 (填写化学式)。
(2)写出反应①的离子方程式 。
(3)反应①之前要洗涤滤渣B,对滤渣B进行洗涤的实验操作方法是
。
(4)稀土元素的提纯,还可采用萃取法。已知化合物HT作为萃取剂能将铈离子从水溶液中萃取出来,过程表示为Ce2(SO4)3 (水层)+ 6HT(有机层) 2CeT3 (有机层)+3H2SO4(水层) ,分液得到CeT3 (有机层),再加入H2SO4 获得较纯的含Ce3+的水溶液。可选择硫酸作反萃取剂的原因是 。
2CeT3 (有机层)+3H2SO4(水层) ,分液得到CeT3 (有机层),再加入H2SO4 获得较纯的含Ce3+的水溶液。可选择硫酸作反萃取剂的原因是 。
(5)用滴定法测定制得的Ce(OH)4产品纯度。
 |
所用FeSO4溶液在空气中露置一段时间后再进行滴定,则测得该Ce(OH)4产品的质
量分数 。(填“偏大”、“偏小”或“无影响”)
(6)已知Fe3+沉淀的pH范围:2.2~3.2,Fe2+沉淀的pH范围:5.8~7.9,Zn2+沉淀的pH范围:5.8~11.0,pH>11时Zn(OH)2能溶于NaOH溶液生成[Zn(OH)4]2-。现用FeSO4溶液(含有ZnSO4杂质)来制备硫酸铁铵矾。实验中可选用的试剂: KMnO4溶液、30%H2O2、 NaOH溶液、饱和石灰水、稀H2SO4溶液、稀盐酸。
实验步骤依次为:
①向含有ZnSO4杂质的FeSO4溶液中,加入足量的NaOH溶液至pH>11, ;
② ;
③向②中得到的溶液中加入硫酸铵溶液, ,过滤、洗涤、常温晾干,得硫酸铁铵晶体(NH4) Fe(SO4)2·12H2O。
查看答案和解析>>
科目:高中化学 来源: 题型:
利用反应2NO(g)+2CO(g) 2CO2(g)+N2(g) ΔH=-746.8 kJ/mol,可净化汽车尾气,如果要同时提高该反应的速率和NO的转化率,采取的措施是( )
A.增大压强同时加催化剂
B.降低温度
C.升高温度同时充入N2
D.及时将CO2和N2从反应体系中移走
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C、D、E均为可溶于水的固体,组成他们的离子有
| 阳离子 | Na+ Mg2+ Al3+ Ba2+ |
| 阴离子 | OH- C |
分别取它们的水溶液进行实验,结果如下:①A溶液与B溶液反应生成白色沉淀,沉淀可溶于E溶液;
②A溶液与C溶液反应生成白色沉淀,沉淀可溶于E溶液;③A溶液与D溶液反应生成白色沉淀,沉淀可溶于盐酸;④B溶液与适量D溶液反应生成白色沉淀,加入过量D溶液,沉淀量减少,但不消失。
(1)据此推断它们是(写化学式)A ;B ;C ;D ;E 。
(2)写出④中反应的离子方程式: 。
(3) A溶液中各种离子浓度由大到小的顺序为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式正确的是( )
A.FeCl3溶液与Cu的反应:Cu+Fe3+===Cu2++Fe2+
B.NO2与水的反应:3NO2+H2O===2NO +NO+2H+
+NO+2H+
C.醋酸溶液与水垢中的CaCO3反应:CaCO3+2H+===Ca2++H2O+CO2↑
D.向NaAlO2溶液中通入过量CO2:2AlO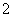 +CO2+3H2O===2Al(OH)3↓+CO
+CO2+3H2O===2Al(OH)3↓+CO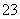
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com