
(10分)海水中化学资源的综合开发利用已受到各国的高度重视。Br2和Mg等两种单质都可以从海水中提取,下图为提取它们的步骤:
请回答:
I.从海水中提取的溴占世界年产量的1/3,主要方法就是上述流程中的空气吹出法。
(1)制取Br2时,第一次通入Cl2发生反应的离子方程式是__________________。
(2)吸收塔中反应的离子方程式是________________________________________。
由(1)、(2)可知,SO2、Cl2、Br2三种物质氧化性由强到弱的顺序是
__________________。( 用“”表示)
II.镁及其合金是用途很广泛的金属材料,而目前世界上60%的镁就是从海水中按上述流程提取的。
(1)上述流程中为了使MgSO4完全转化为Mg(OH)2,试剂①可以选用___________(写化学式)。
(2)加入试剂②后反应泊离子方程式是_________________________________。
(3)步骤①包括加热、蒸发、冷却、结晶、_________。
(4)通电时无水MgCl2在熔融状态下反应的化学方程式是
___________________________________________________。
III.上述流程在生产溴和镁的同时还可以制得其他化工物质,比如制备耐火材料氧化镁和盐酸。生产方法是:
①将氯化镁晶体(MgCl2·6H2O)加热到523OC以上,该晶体可以分解得到耐火材料氧化镁和两种气态化合物,其中一种气体常温下为无色液体。
②将两种气体冷却到室温,再根据需要,加入不同量的水,就可得到不同浓度的盐酸。
(1)MgCl2·6H2O在523OC以上分解的化学方程式是_____________________________。
(2)现用1mol MgCl2·6H2O分解所得的非固体产物来制取密度为1.19g/cm3的盐酸溶液168mL,需加水__________g(精确到0.1),该盐酸中溶质的物质的量浓度是____________mol/L(精确到0.1)。
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:2011-2012学年河北省枣强县中学高一下学期期末考试化学试卷(带解析) 题型:填空题
(10分)(2011·锦州高一检测)目前世界上60%的镁是从海水提取的。海水提镁的主要流程如下: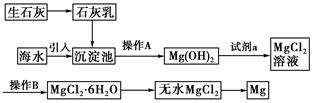
请回答下列问题:
(1)从离子反应的角度思考,在海水中加入石灰乳的作用是________,写出在沉淀池发生反应的离子方程式 ________________________________________________________.
(2)石灰乳是生石灰与水形成的化合物,从充分利用海洋化学资源,提高经济效益的角度考虑,生产生石灰的主要原料来源于海洋中的________________________。
(3)操作A是________,操作B是________。
(4)加入的足量试剂a是________(填化学式)。
(5)无水MgCl2在熔融状态下,通电后会产生Mg和Cl2,该反应的化学方程式为______________________________________________________________________。
从考虑成本和废物循环利用的角度,副产物氯气可以用于
__________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源:09-10年北京市朝阳区高一下学期期末考试化学卷 题型:填空题
(10分)海水中化学资源的综合开发利用已受到各国的高度重视。Br2和Mg等两种单质都可以从海水中提取,下图为提取它们的步骤:

请回答:
I.从海水中提取的溴占世界年产量的1/3,主要方法就是上述流程中的空气吹出法。
(1)制取Br2时,第一次通入Cl2发生反应的离子方程式是__________________。
(2)吸收塔中反应的离子方程式是________________________________________。
由(1)、(2)可知,SO2、Cl2、Br2三种物质氧化性由强到弱的顺序是
__________________。( 用“”表示)
II.镁及其合金是用途很广泛的金属材料,而目前世界上60%的镁就是从海水中按上述流程提取的。
(1)上述流程中为了使MgSO4完全转化为Mg(OH)2,试剂①可以选用___________(写化学式)。
(2)加入试剂②后反应泊离子方程式是_________________________________。
(3)步骤①包括加热、蒸发、冷却、结晶、_________。
(4)通电时无水MgCl2在熔融状态下反应的化学方程式是
___________________________________________________。
III.上述流程在生产溴和镁的同时还可以制得其他化工物质,比如制备耐火材料氧化镁和盐酸。生产方法是:
①将氯化镁晶体(MgCl2·6H2O)加热到523OC以上,该晶体可以分解得到耐火材料氧化镁和两种气态化合物,其中一种气体常温下为无色液体。
②将两种气体冷却到室温,再根据需要,加入不同量的水,就可得到不同浓度的盐酸。
(1)MgCl2·6H2O在523OC以上分解的化学方程式是_____________________________。
(2)现用1mol MgCl2·6H2O分解所得的非固体产物来制取密度为1.19g/cm3的盐酸溶液168mL,需加水__________g(精确到0.1),该盐酸中溶质的物质的量浓度是____________mol/L(精确到0.1)。
查看答案和解析>>
科目:高中化学 来源:09~10年北京市朝阳区高一下学期期末考试化学卷 题型:填空题
(10分)海水中化学资源的综合开发利用已受到各国的高度重视。Br2和Mg等两种单质都可以从海水中提取,下图为提取它们的步骤: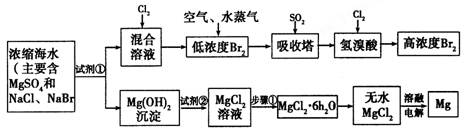
请回答:
I.从海水中提取的溴占世界年产量的1/3,主要方法就是上述流程中的空气吹出法。
(1)制取Br2时,第一次通入Cl2发生反应的离子方程式是__________________。
(2)吸收塔中反应的离子方程式是________________________________________。
由(1)、(2)可知,SO2、Cl2、Br2三种物质氧化性由强到弱的顺序是
__________________。( 用“”表示)
II.镁及其合金是用途很广泛的金属材料,而目前世界上60%的镁就是从海水中按上述流程提取的。
(1)上述流程中为了使MgSO4完全转化为Mg(OH)2,试剂①可以选用___________(写化学式)。
(2)加入试剂②后反应泊离子方程式是_________________________________。
(3)步骤①包括加热、蒸发、冷却、结晶、_________。
(4)通电时无水MgCl2在熔融状态下反应的化学方程式是
___________________________________________________。
III.上述流程在生产溴和镁的同时还可以制得其他化工物质,比如制备耐火材料氧化镁和盐酸。生产方法是:
①将氯化镁晶体(MgCl2·6H2O)加热到523OC以上,该晶体可以分解得到耐火材料氧化镁和两种气态化合物,其中一种气体常温下为无色液体。
②将两种气体冷却到室温,再根据需要,加入不同量的水,就可得到不同浓度的盐酸。
(1)MgCl2·6H2O在523OC以上分解的化学方程式是_____________________________。
(2)现用1mol MgCl2·6H2O分解所得的非固体产物来制取密度为1.19g/cm3的盐酸溶液168mL,需加水__________g(精确到0.1),该盐酸中溶质的物质的量浓度是____________mol/L(精确到0.1)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com