
【题目】按要求填空:
(1)有机物![]() 的系统名称是_______________________,将其在催化剂存在下完全氢化,所得烷烃的系统名称是__________________。
的系统名称是_______________________,将其在催化剂存在下完全氢化,所得烷烃的系统名称是__________________。
(2)苯的同系物中,有的侧链能被酸性高锰酸钾溶液氧化,生成芳香酸,反应如下:(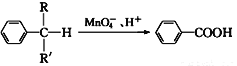 R、R′表示烷基或氢原子),但若侧链上直接与苯环连接的原子上没有C—H键,则不容易被氧化。
R、R′表示烷基或氢原子),但若侧链上直接与苯环连接的原子上没有C—H键,则不容易被氧化。
①现有苯的同系物甲和乙,分子式都是C10H14。甲不能被酸性高锰酸钾溶液氧化为芳香 酸,它的结构简式是________________________;
②有机物丙也是苯的同系物,分子式也是C10H14,它的苯环上的一溴代物只有一种。丙的结构简式共有四种,写出其余三种: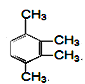 __________、_________________、______________
__________、_________________、______________
 导学教程高中新课标系列答案
导学教程高中新课标系列答案科目:高中化学 来源: 题型:
【题目】炔烃的偶联反应在开发新型发光材料、超分子等领域有重要研究价值。乙炔发生的偶联反应为 2CH≡CH ![]() CH≡CC≡CH+H2。乙炔偶联反应过程中能量变化如图甲中曲线Ⅰ所示,曲线Ⅱ为改变某一条件的能量变化。下列说法不正确的是( )
CH≡CC≡CH+H2。乙炔偶联反应过程中能量变化如图甲中曲线Ⅰ所示,曲线Ⅱ为改变某一条件的能量变化。下列说法不正确的是( )
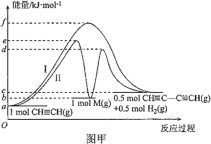
A.曲线Ⅰ,反应物的总键能大于生成物的总键能
B.曲线Ⅱ改变的条件是加入了催化剂
C.曲线Ⅱ对应条件下,第一步反应的 ΔH=+(b-a)kJ·mol-1
D.曲线Ⅱ对应条件下,决定总反应速率的大小是第二步反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分。
碳 | 氮 | Y | |
X | 硫 | Z |
回答下列问题
(1)Z元素在周期表中的位置为__________。
(2)元素周期表中与Z元素同周期原子半径最大的是(写元素名称)__________,其最高价氧化物对应的水化物含有的化学键类型____________。
(3)下列事实能说明Y元素的非金属性比硫元素的非金属性强的是___;
a.Y单质与H2S溶液反应,溶液变浑浊
b.在氧化还原反应中,1molY单质比1molS得电子多
c.Y和S两元素的简单氢化物受热分解,前者的分解温度高
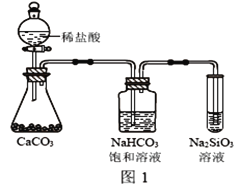
(4)根据下图实验,可以证明碳的非金属性比X强。饱和小苏打溶液的作用__________。发生的离子方程式是:__________________
(5)重水(D2O)是重要的核工业原料,下列说法错误的是________。
a.氘(D)原子核内有1个中子
b.1H与D互称同位素
c.H2O与D2O互称同素异形体
d.1H218O与D216O的相对分子质量相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D是1~18号元素中的四种,0.5molA元素的离子得到6.02×1023个电子被还原为中性原子,0.4g A的氧化物恰好与100mL0.2mol/L的盐酸完全反应,A原子核内质子数与中子数相等。B是地壳中含量最多的金属元素。C得到一个电子后与氩的电子层结构相同,其最高价氧化物的水化物为自然界最强的含氧酸。D元素是构成有机物的主要元素,其最内层电子数是最外层电子数的一半。
(1)A的单质可在D的最高价氧化物中燃烧得到一种白色固体和一种黑色固体,试写出其化学方程式______________________________。
(2)A、B、C的离子半径由大到小顺序为:______________。(用离子符号表示)
(3)向10mL浓度为1mol/L的B、C两元素形成的化合物的水溶液里逐滴滴入35mL浓度为1mol/L的苛性钠溶液,现象是______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁及其化合物有重要且广泛的应用
(1)基态Fe2+的价层电子的轨道表示式为_____________
(2)检验Fe3+可以用KSCN溶液,写出SCN-的一种等电子体分子_______。
(3)部分电离能数据如下表:
元素 | Mn | Fe | |
电离能(kJ/mol) |
| 717 | 759 |
| 1 509 | 1 561 | |
| 3 248 | 2 957 | |
根据表中数据可知,气态Mn2+ 再失去一个电子比气态Fe2+ 再失去一个电子难,其原因是_______________________________________________________
(4)过渡金属原子可以与CO分子形成配合物,配合物价电子总数符合“18电子规则”。如Cr可以与CO形成Cr(CO)6 分子:价电子总数(18)= Cr的价电子数(6)+CO提供电子数(2×6).Fe原子也能与CO形成配合物,其化学式为________.
(5)FeS2晶体的晶胞如图所示。晶胞边长为a nm、FeS2相对式量为M,阿伏加德罗常数的值为NA,其晶体密度的计算表达式为___________g·cm3。
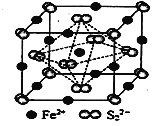
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关电化学的内容正确的是
A.马口铁和白铁皮破损后,白铁皮比马口铁腐蚀快,所以使用白铁皮时要注意防止铁皮出现刮痕
B.原电池中电子从负极流出流入正极,电解池中电子从阴极流出流入电源负极
C.已知磷酸亚铁锂电池总反应为FePO4+ Li![]() LiFePO4,电池中的固体电解质可传导Li+,则该电池充电时阳极电极反应式为:LiFePO4-e-=FePO4+Li+
LiFePO4,电池中的固体电解质可传导Li+,则该电池充电时阳极电极反应式为:LiFePO4-e-=FePO4+Li+
D.常温下以C选项中电池为电源以石墨为电极电解200mL饱和食盐水,当消耗1.4g Li时,溶液的pH为13(忽略溶液的体积变化)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列图示所得出的结论不正确的是
A. 图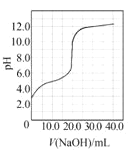 是室温下用0.1000 mol·L1NaOH溶液滴定20.00 mL 0.1000 mol·L1某一元酸HX的滴定曲线,说明HX是一元强酸
是室温下用0.1000 mol·L1NaOH溶液滴定20.00 mL 0.1000 mol·L1某一元酸HX的滴定曲线,说明HX是一元强酸
B. 图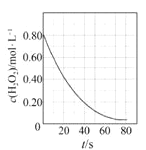 是室温下H2O2催化分解放出氧气的反应中c(H2O2 )随反应时间变化的曲线,说明随着反应的进行H2O2分解速率逐渐减小
是室温下H2O2催化分解放出氧气的反应中c(H2O2 )随反应时间变化的曲线,说明随着反应的进行H2O2分解速率逐渐减小
C. 图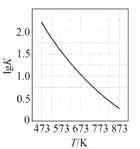 是CO(g)+H2O(g)
是CO(g)+H2O(g)![]() CO2(g)+H2(g)的平衡常数与反应温度的关系曲线,说明该反应的ΔH<0
CO2(g)+H2(g)的平衡常数与反应温度的关系曲线,说明该反应的ΔH<0
D. 图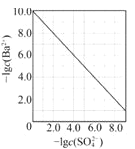 是室温下用Na2SO4除去溶液中Ba2+达到沉淀溶解平衡时,溶液中c(Ba2+ )与c(SO42)的关系曲线,说明溶液中c(SO42 )越大c(Ba2+ )越小
是室温下用Na2SO4除去溶液中Ba2+达到沉淀溶解平衡时,溶液中c(Ba2+ )与c(SO42)的关系曲线,说明溶液中c(SO42 )越大c(Ba2+ )越小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将![]() mL 1mo/L
mL 1mo/L ![]() 和
和![]() mL 1mo/L
mL 1mo/L ![]() 两种酸溶液分别加水稀释,稀释溶液体积为V,稀释液pH与其体积变化的关系如图所示。下列说法正确的是
两种酸溶液分别加水稀释,稀释溶液体积为V,稀释液pH与其体积变化的关系如图所示。下列说法正确的是
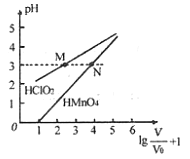
A. ![]() 和
和![]() 均为一元弱酸
均为一元弱酸
B. 在0≤pH≤5时,![]() 溶液满足
溶液满足![]()
C. 分别往M、N两点对应溶液中滴加1 mo/L NaOH溶液至恰好完全反应,消耗NaOH溶液的体积相等
D. 常温下,浓度均为0.1 mo/L的![]() 和
和![]() 溶液,溶液pH:
溶液,溶液pH:![]() >
>![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com