
| A. | 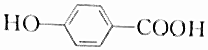 | |
| B. | 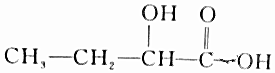 | |
| C. | 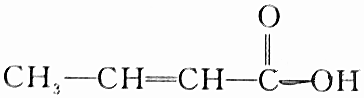 | |
| D. | 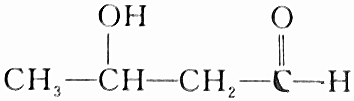 |
分析 酚-OH、-COOH具有酸性,-OH、-COOH可发生酯化反应,-OH可发生消去反应,但与-OH相连的C的邻位C上必须有H,以此来解答.
解答 解:A.含酚-OH、-COOH,具有酸性、可发生酯化反应,但不能发生消去反应,故A不选;
B.含-COOH具有酸性,含-OH、-COOH可发生酯化反应,且与-OH相连的C的邻位C上有H,可发生消去反应,故B选;
C.含-COOH,具有酸性、可发生酯化反应,但不能发生消去反应,故C不选;
D.含-OH可发生酯化反应,且与-OH相连的C的邻位C上有H,可发生消去反应,但不具有酸性,故D不选.
故选B.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系为解答的关键,侧重酚、醇、羧酸性质的考查,题目难度不大,注意醇消去反应的结构特点.


科目:高中化学 来源: 题型:推断题
 现有A、B、C、D、E、F、G、H、M九种物质,其中A、B、C均为氧化物,且A为淡黄色粉末,G、E为气体单质,F的水溶液与石灰水混合可制得D的溶液.它们之间相互转化关系如图所示,其他与题目无关的生成物均已略去.
现有A、B、C、D、E、F、G、H、M九种物质,其中A、B、C均为氧化物,且A为淡黄色粉末,G、E为气体单质,F的水溶液与石灰水混合可制得D的溶液.它们之间相互转化关系如图所示,其他与题目无关的生成物均已略去.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在硝酸亚铁溶液中:Al3+、H+、SO42-、Cl- | |
| B. | 在透明溶液中:Fe3+、Mg2+、NO3-、HCO3- | |
| C. | 在含SO2的溶液中:Fe3+、Na+、Cl-、SO42- | |
| D. | pH=0的溶液中:NH4+、Fe2+、SO42-、Br- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ba2+、Fe3+、Br-、SO42- | B. | Na+、Ca2+、HCO3-、OH- | ||
| C. | Al3+、NH4+、SO42-、Cl- | D. | Na+、H+、NO3-、SO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某放热反应能自发进行.因此该反应是熵增反应 | |
| B. | Fe(OH)3胶体无色、透明,不能透过滤纸 | |
| C. | 单质硅是将太阳能转变为电能的常用材料 | |
| D. | SiO2既能和NaOH溶液反应又能和氢氟酸反应,所以是两性氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.5mol/L | B. | 1.0mol/L | C. | 2.0mol/L | D. | 3.0mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学式 | H2(g) | CO(g) | CH3OH(l) |
| 标准燃烧热(25℃) △H/kJ•mol-1 | -285.8 | -283.0 | -726.5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com