
 通城学典默写能手系列答案
通城学典默写能手系列答案科目:高中化学 来源: 题型:阅读理解

查看答案和解析>>
科目:高中化学 来源: 题型:

| 时间 \CO转化率 \温度 |
1小时 | 2小时 | 3小时 | 4小时 |
| T1 | 30% | 50% | 80% | 80% |
| T2 | 35% | 60% | a1 | a2 |
查看答案和解析>>
科目:高中化学 来源:2012年鲁科版高中化学选修6 4酿制米酒练习卷(解析版) 题型:填空题
为了探究乙醇和金属钠反应的原理,做了如下四个实验:
实验一:向小烧杯中加入无水乙醇,再放入一小块金属钠,观察现象,并收集产生的气体。
实验二:设法检验实验一收集到的气体。
实验三:向试管中加入3 mL水,并加入一小块金属钠,观察现象。
实验四:向试管中加入3 mL 乙醚(结构简式为C2H5—O—C2H5),并加入一小块金属钠,观察现象。
回答以下问题:
(1)简述实验二中检验气体的实验方法及作出判断的依据:
________________________________________________________________________
________________________________________________________________________。
(2)从结构上分析,该实验选取水和乙醚做参照物的原因是
________________________________________________________________________
________________________________________________________________________。
(3)实验三的目的是欲证明
________________________________________________________________________;
实验四的目的是欲证明
________________________________________________________________________;
根据实验三和实验四的结果,可以证明乙醇和金属钠反应的化学方程式应为________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年江西省、临川一中高三8月联考化学试卷(解析版) 题型:填空题
(9分) 已知X、Y、Z是阳离子,K是阴离子,M、N是分子。它们都由短周期元素组成,且具有以下结构特征和性质:
①它们的核外电子总数都相同;
②N溶于M中,滴入酚酞,溶液变红;
③Y和K都由A.B两元素组成,Y核内质子数比K多2个;
④X和N都由A、C两元素组成,X和Y核内质子总数相等;
⑤X和K的浓溶液在加热条件下生成M和N;
⑥Z为单核离子,向含有Z的溶液中加入少量含K的溶液,有白色沉淀生成,再加入过量的含K或Y的溶液,沉淀消失。
回答下列问题:
(1)Y的化学式为 ;N的电子式为
(2)试比较M和N的稳定性:M (填“>”或“<”)N。
(3)写出Z和N的水溶液反应的离子方程式: ;
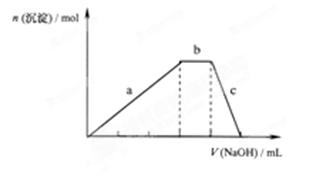
(4))上述六种微粒中的两种可与硫酸根形成一种含三种离子的盐,向该盐的浓溶液中逐滴加入0.1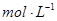 的NaOH溶液,出现了如图中a、b、c三个阶段的图像,
的NaOH溶液,出现了如图中a、b、c三个阶段的图像,
①写b出阶段的离子方程式:
②根据图像判断该盐的化学式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com