
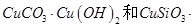
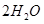 ��ͬʱ����
��ͬʱ����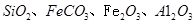 �����ʡ��Թ��ȸʯΪԭ����ȡ����ͭ�Ĺ�����������ͼ��
�����ʡ��Թ��ȸʯΪԭ����ȡ����ͭ�Ĺ�����������ͼ��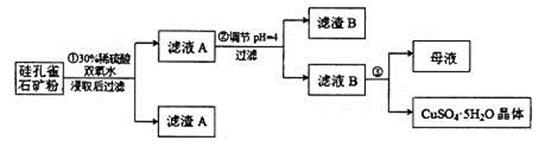
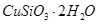 ������Ӧ�Ļ�ѧ����ʽ
������Ӧ�Ļ�ѧ����ʽ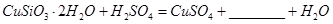 ��
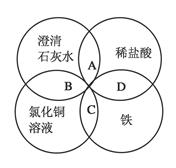
��A��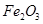 | B��CuO | C��A12O3 | D��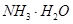 |
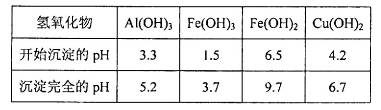
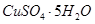 ���塣ijͬѧ��Ϊ������������������������������������������ݶԸ�ͬѧ�Ĺ۵��������ۣ���֪�����£�
���塣ijͬѧ��Ϊ������������������������������������������ݶԸ�ͬѧ�Ĺ۵��������ۣ���֪�����£�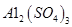 ������Һ��
������Һ��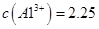 mol
mol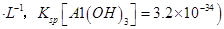 ______________��
______________��

 ��ʦָ����ĩ��̾�ϵ�д�
��ʦָ����ĩ��̾�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��NO2ͨ��ˮ�У�3NO2��H2O=2H����2NO3����NO |
B��������ͭ�缫���CuSO4��Һ��2Cu2����2H2O 2Cu��O2����4H�� 2Cu��O2����4H�� |
| C��SO2ͨ��FeCl3��Һ�У�SO2��Fe3����2H2O=SO42����Fe2����4H�� |
| D��������CO2ͨ��NaAlO2��Һ�У�2AlO2����CO2��3H2O=2Al(OH)3����CO32�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
A������ɫ�ĵ�����Һ��ͨ������SO2������ɫ��Һ:I2+SO2+2H2O 2I-+SO42��+4H+ 2I-+SO42��+4H+ |
B����֪����ƽ�ⳣ��:H2CO3>HClO>HCO32��,��NaClO��Һ��ͨ������������̼:2ClO-+CO2+H2O 2HClO+CO42�� 2HClO+CO42�� |
C��NH4HCO3��Һ�����NaOH��Һ��Ӧ:NH4++OH- NH3��+H2O NH3��+H2O |
D��FeI2��Һ��ͨ�����Cl2:2Fe2++2I-+2Cl2 2Fe3++I2+4Cl- 2Fe3++I2+4Cl- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
A��þ�뼫ϡ���ᷴӦ��������淋����ӷ���ʽΪ:4Mg+6H++N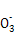 =4Mg2++N =4Mg2++N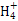 +3H2O +3H2O |
| B��������,0.1 mol/LһԪ��HA��Һ��c(OH-)/c(H+)=1��10-8,�����Һ��pH=3 |
| C����ͬ������,Ũ�Ⱦ�Ϊ0.01 mol/L��NH4Cl��Һ��NaCl��Һ��,ǰ�ߵ���������Ũ�ȴ��ں��ߵ���������Ũ�� |
| D�����ʵ���Ũ����ȵĴ��������������Һ�������Ϻ����Һ��:c(Na+)+c(H+)=c(CH3COO-)+c(OH-)+c(CH3COOH) |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
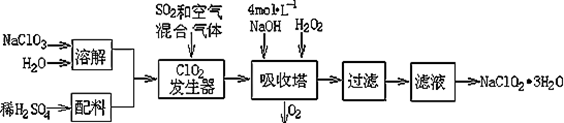
| ���� | HClO2 | HF | HCN | H2S |
| Ka/mol?L-1 | 1��10-2 | 6��3��10-4 | 4��9��10-10 | K1��9��1��10?8 K2��1��1��10?12 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
A��Na2O2��H2O��Ӧ:2 +2H2O +2H2O 4OH-+O2�� 4OH-+O2�� |
B��FeCl2��Һ��ϡ���ᷴӦ:Fe2++N +4H+ +4H+ Fe3++NO��+2H2O Fe3++NO��+2H2O |
C��CaCO3�������Һ��Ӧ:CaCO3+2H+ Ca2++CO2��+H2O Ca2++CO2��+H2O |
D��KAl(SO4)2��Һ�백ˮ��Ӧ:Al3++3NH3��H2O Al(OH)3��+3N Al(OH)3��+3N |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| ѡ�� | ��ѧ��Ӧ�������ӷ���ʽ | ���� |
| A | Fe3O4��ϡ���ᷴӦ��2Fe3O4+18H+ =6Fe3++H2��+8H2O | ��ȷ |
| B | ��̼��þ�м���ϡ��� +2H+ =CO2��+H2O +2H+ =CO2��+H2O | ����̼��þ��Ӧд��������ʽ |
| C | ���������Һ�м�������������Һ�� Ba2++  =" " BaSO4�� =" " BaSO4�� | ��ȷ |
| D | FeBr2��Һ������ʵ�����Cl2��Ӧ�� 2Fe2++2Br-+2Cl2=2Fe3++4Cl-+Br2 | ����Fe2+��Br-�Ļ�ѧ������֮��ӦΪ1��2 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com