
| 250 |
| 25 |
| 5×392cV |
| m |
| 5×392cV |
| m |


科目:高中化学 来源:学习周报 化学 人教课标高一版(必修1) 2009-2010学年 第13期 总第169期 人教课标版 题型:058
| |||||||||||||||||||||||||||||
查看答案和解析>>
科目:高中化学 来源:英德中学2007届高三化学第二轮复习专题强化训练7 题型:058
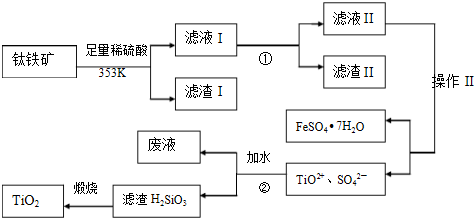
钛被称为继铁、铝之后的第三金属,也有人说“21世纪将是钛的世纪”.
(1)二氧化钛在现代社会里有广泛的用途,它的产量是一个国家国民经济发展程度的标志.我国至今产量不足,尚需进口二氧化钛.“硫酸法”生产二氧化钛的原料是钛铁矿(主要成分是:FeTiO3,还含有少量Mn、Zn、Cr、Cu等重金属元素及脉石等杂质),主要生产流程是:
①将钛铁矿与浓H2SO4煮解:FeTiO3+2H2SO4(浓)===TiOSO4+FeSO4+2H2O(硫酸钛酰)
②加水分解硫酸氧钛:TiOSO4+(n+1)H2O===TiO2·nH2O+H2SO4
③
煅烧TiO2·nH2O“硫酸法”生产TiO2排放的废液对水体有哪些污染,请指出主要的二点:
①________;
②________.
根据废液主要成分,针对其中一项污染,提出处理的方法.③________
(2)某化学兴趣小组对Mg、Ti、Cu三种金属的金属活动性顺序进行探究.
提出假设:a.Ti金属活动性比Mg强;b.Ti金属活动性比Cu弱.
查阅资料:在相同条件下,金属与酸反应产生气泡的速度快,则该金属活动性越强.
实验设计:同温下,取大小相同的这三种金属薄片,用砂布将表面擦光亮,分别投入等体积等浓度的足量稀盐酸和稀HF溶液中反应,观察现象.
①稀盐酸:放出H2速率Mg>Ti,铜不反应.②稀HF:放出H2速率Ti>Mg
根据上述________现象(填①或②)得出金属活动性Mg________Ti.如何解释另一反常现象________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com