
分析 (1)反应中S元素的化合价从+4价升高到+6价,Mn元素的化合价从+7价降低到+2价,结合得失电子守恒和原子守恒配平,然后改写为离子方程式;
(2)反应中Cu元素的化合价从0价升高到+2价,N元素的化合价从+5价降低到+2价,结合得失电子守恒和原子守恒配平,然后改写为离子方程.
解答 解:(1)反应中S元素的化合价从+4价升高到+6价,Mn元素的化合价从+7价降低到+2价,结合得失电子守恒和原子守恒配平方程式为:5SO2+2KMnO4+2H2O=K2SO4+2MnSO4+2H2SO4,其离子方程式5SO2+2MnO4-+2H2O=2 Mn2++4H++5SO42-;
故答案为:5、2、2、1、2、2;5SO2+2MnO4-+2H2O=2 Mn2++4H++5SO42-;
(2)反应中Cu元素的化合价从0价升高到+2价,N元素的化合价从+5价降低到+2价,结合得失电子守恒和原子守恒配平为3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O
,其离子方程3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O;
故答案为:3、8、3、2、4;3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O.
点评 本题考查氧化还原反应、离子方程式的书写,题目难度不大,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应基本概念的考查,注意从元素化合价角度分析.


科目:高中化学 来源: 题型:选择题
| A. | 原子半径 B>A>C>D | B. | 最高价氧化物水化物的碱性B>A | ||
| C. | 离子半径 C3->D->B+>A2+ | D. | 氢化物的稳定性 C>D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化氢溶于水能电离出H+、Cl-,所以氯化氢是离子化合物 | |
| B. | 碘晶体受热转变成碘蒸气,吸收的热量用于克服碘原子之间的作用力 | |
| C. | 烧碱固体溶于水的过程中,共价键被破坏 | |
| D. | 有机化合物CH3CH2NO2与H2N-CH2-COOH是同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 60g丙醇中存在的共价键总数为10NA | |
| B. | 1L 0.1mol•L-1的NaHCO3溶液中HCO3-和CO32-离子数之和为0.1NA | |
| C. | 钠在空气中燃烧可生成多种氧化物.23g钠充分燃烧时转移电子数为1NA | |
| D. | 常温下,pH=13的NaOH溶液中含有OH-的数目为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
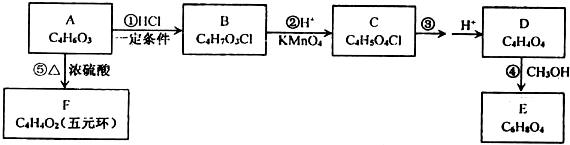
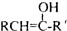 (R和 R′,代表烷基或 H)不稳定,本题各物质均不考虑此类结构.
(R和 R′,代表烷基或 H)不稳定,本题各物质均不考虑此类结构. 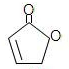 E(反式):
E(反式):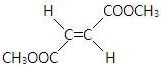
 .
.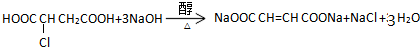 .
. .
.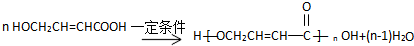 .
.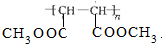 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
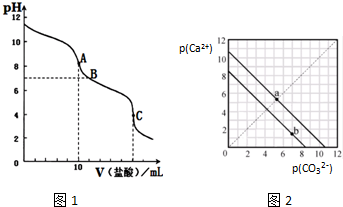
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
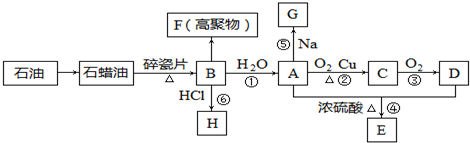
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com