
| HX | HY | HZ | |
| 浓度 mol•L-1 | 0.1 0.5 | 1.0 1.5 | 2.0 2.5 |
| 电离度 | 0.3% 0.13% | 0.3% 0.24% | 0.5% 0.45% |
分析 (1)部分电离的电解质为弱电解质,在水溶液中和熔融状态下都不导电的化合物是非电解质;
(2)亚硫酸是二元弱酸,在水溶液中分步电离,第一步电离生成H+和HSO3-;次氯酸钠是强电解质,在水溶液中完全电离生成ClO-和Na+;
(3)相同溶质的弱电解质溶液中,溶液浓度越小电解质的电离程度越大;
(4)在相同状态下,不同弱酸电离度越大其酸性越强;
(5)当正逆反应速率相等时可逆反应达到平衡状态,平衡体系中各物质的物质的量、物质的量浓度、百分含量以及由此引起的一系列物理量不变.
解答 解:(1)①亚硫酸溶液是混合物,既不是电解质也不是非电解质;
②次氯酸钠属于盐,是你强电解质;
③氯化氢气体溶于水完全电离,属于强电解质;
④蔗糖在熔融状态下和水溶液里均不能导电,属于化合物,是非电解质;
⑤硫酸钡属于盐,熔融状态下完全电离,属于强电解质;
⑥氨气本身不能电离出自由移动的离子,属于化合物,是非电解质;
⑦冰醋酸溶于水后能部分电离出醋酸根离子和氢离子,属于弱电解质;
⑧硫酸氢钠固体属于盐,熔融状态和在水溶液里均能完全电离,属于强电解质;
⑨氢氧化铁属于弱碱,部分电离,是你弱电解质;
⑩NO2本身不能电离出自由移动的离子,属于非电解质,故答案为:⑦⑨,④⑥⑩;
(2)亚硫酸是二元弱酸,在水溶液中分步电离,第一步电离生成H+和HSO3-,其电离方程式为H2SO3?H++HSO3-;
次氯酸钠是强电解质,在水溶液中完全电离生成ClO-和Na+,其电离方程式为NaClO═ClO-+Na+,
故答案为:H2SO3?H++HSO3-;NaClO═ClO-+Na+;
(3)一水合氨是弱电解质,在溶液里存在电离平衡,氨水的浓度越大,一水合氨的电离程度越小,浓度越小,一水合氨的电离程度越大,
甲瓶氨水的浓度是乙瓶氨水的浓度的10倍,由弱电解质的浓度越小,电离程度越大,故甲瓶氨水的电离度比乙瓶氨水的电离度小,
所以甲、乙两瓶氨水中[OH-]之比小于10,故答案为:小于;
(4)由电离度大小可知酸性HZ>HY>HX,故答案为:HZ>HY>HX;
(5)①只有二氧化氮有色,当混合气体的颜色不再改变时,二氧化氮的物质的量不变,说明该反应达到平衡状态,故正确;
②容器体积不变、混合气体质量不变,所以无论是否达到平衡状态,混合气体密度始终不变,混合气体的密度不再改变的状态不一定达到平衡,故错误;
③反应前后气体压强增大,当混合气体的压强不再改变时,该反应达到平衡状态,故正确;
④反应前后气体的物质的量增大,所以其相对分子质量减小,当混合气体的平均相对分子质量不再改变时,各物质的物质的量不变,反应达到平衡状态,故正确;
⑤反应前后$\frac{{c}^{2}(N{O}_{2})}{{c}^{2}(NO)c({O}_{2})}$的比值减小,当$\frac{{c}^{2}(N{O}_{2})}{{c}^{2}(NO)c({O}_{2})}$的比值不再改变时各物质的浓度不变,反应达到平衡状态,故正确;
故选:①③④⑤.
点评 本题考查较综合,涉及强弱电解质判断、弱电解质电离平衡、化学平衡状态判断等知识点,为高频考点,侧重考查学生分析判断及对基本概念的理解能力,明确“只有反应前后改变的物理量不变时可逆反应达到平衡状态”是解答(5)题的关键,题目难度不大.


 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案科目:高中化学 来源:2016-2017学年西藏拉萨中学高二上第一次月考化学试卷(解析版) 题型:选择题
在化学反应A(g)+3B(g)  2C(g)+D(g)中,各物质的平均反应速率间的关系式正确的是
2C(g)+D(g)中,各物质的平均反应速率间的关系式正确的是
A.v(A)=v(B) B.v(A)=2v(C) C.3v(B)=v(C) D.v(B)=3v(D)
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
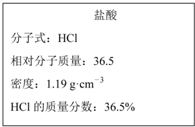 如图为实验室某浓盐酸试剂瓶上的标签的有关内容,试根据标签上的有关数据回答下列问题:
如图为实验室某浓盐酸试剂瓶上的标签的有关内容,试根据标签上的有关数据回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 室温下向10mL 0.1mol•L-1 NaOH溶液中逐滴加入0.1mol•L-1的一元酸HA,溶液pH的变化曲线如图所示.
室温下向10mL 0.1mol•L-1 NaOH溶液中逐滴加入0.1mol•L-1的一元酸HA,溶液pH的变化曲线如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 序号 | 消耗盐酸的体积/mL | 待测KOH溶液的体积/mL |
| 1 | 27.23 | 25.00 |
| 2 | 28.24 | 25.00 |
| 3 | 27.25 | 25.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 中和10mL 1 mol•L-1 CH3COOH溶液需要10 mL 1 mol•L-1 NaOH溶液 | |
| B. | 物质的量浓度相同时,锌粒跟盐酸反应的速率比跟醋酸反应的速率快 | |
| C. | 0.01mol•L-1醋酸溶液的pH大于2 | |
| D. | 0.1mol•L-1 CH3COONa溶液显碱性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 物质的量浓度和体积都相同的盐酸和醋酸溶液,在与足量锌反应时,起始时二者产生H2速率基本相等 | |
| B. | 100mL1mol•L-1的盐酸和50mL2mol•L-1的盐酸,分别与足量的锌反应时,两者放出H2速率和质量均相等 | |
| C. | 100mLpH=3的H2SO4和HCl溶液,与足量锌反应后,放出H2的质量相等 | |
| D. | 100mLpH=3的盐酸与醋酸溶液,与足量锌反应后,所得H2的质量相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2,3-二甲基丁烷 | B. | 2-甲基-4-乙基-1-己烯 | ||
| C. | 3-甲基-1-丁烯 | D. | 3,3-二甲基-2-戊烯 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com