
分析 溶液中c(Na+)=c(CH3COO-),根据电荷守恒判断c(H+)、c(OH-)相对大小,从而确定溶液酸碱性;混合溶液呈中性,二者物质的量浓度相等,醋酸钠溶液呈碱性,要使混合溶液呈中性,则醋酸物质的量应该稍微大些.
解答 解:物质的量浓度相同的醋酸和氢氧化钠溶液混合后,溶液中c(Na+)=c(CH3COO-),根据电荷守恒可知:c(H+)=c(OH-),说明反应后溶液呈中性;
混合溶液呈中性,二者物质的量浓度相等,醋酸钠溶液呈碱性,要使混合溶液呈中性,醋酸的物质的量应该稍大些,所以醋酸溶液体积大于NaOH溶液体积,
故答案为:中性;大于;
点评 本题考查溶液酸碱性与溶液pH的计算、弱电解质的电离等知识,明确弱电解质的电离特点为解答关键,注意掌握溶液酸碱性与溶液pH的关系,试题培养了学生的分析能力及灵活应用能力.


 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案科目:高中化学 来源: 题型:实验题
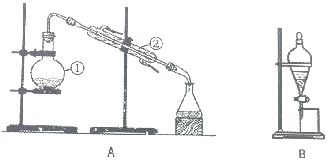 如图装置是实验室中物质分离的常用装置,请回答下列问题.
如图装置是实验室中物质分离的常用装置,请回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
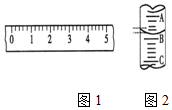 (1)某学生用托盘天平称量一个小烧杯的质量,如小烧杯的质量为32.6g,用“↓”表示在托盘上放砝码,“↑”表示从托盘上取砝码,请用箭头在表中填空,表示称量过程,并在如图1所示的游码尺上画出游码的位置(画“|”表示).
(1)某学生用托盘天平称量一个小烧杯的质量,如小烧杯的质量为32.6g,用“↓”表示在托盘上放砝码,“↑”表示从托盘上取砝码,请用箭头在表中填空,表示称量过程,并在如图1所示的游码尺上画出游码的位置(画“|”表示).| 砝码质量/g | 50 | 20 | 20 | 10 | 5 |
| 取用砝码情况 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
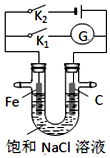
| A. | K1闭合,石墨棒周围溶液pH逐渐升高 | |
| B. | K1闭合,铁棒上发生的反应为2H++2e→H2↑ | |
| C. | K2闭合,铁棒不会被腐蚀,属于牺牲阳极的阴极保护法 | |
| D. | K2闭合,电路中通过0.002 NA个电子时,两极共产生0.001 mol气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
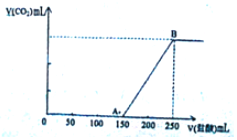 向100mL某物质的量浓度的NaOH溶液中缓慢通入一定量的CO2,充分反应后,向所得溶液中逐滴滴入1mol/L的盐酸溶液,所得气体的体积(标准状态)与所加盐酸的体积关系如图所示
向100mL某物质的量浓度的NaOH溶液中缓慢通入一定量的CO2,充分反应后,向所得溶液中逐滴滴入1mol/L的盐酸溶液,所得气体的体积(标准状态)与所加盐酸的体积关系如图所示查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧化钠是离子化合物,该物质中只存在离子键 | |
| B. | 干冰在升华的过程中,只需要克服分子间作用力 | |
| C. | 12 C与 13 C由于核外电子排布不同,所以属于同位素 | |
| D. | 在 N2、CO2 和 SiO2 三种物质中,都存在共价键,它们都是由分子构成的物质 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com