
【题目】(1)Zn粒和稀盐酸反应一段时间后,反应速率会减慢,当加热或加入浓盐酸后,反应速率明显加快。由此判断,影响化学反应速率的因素有______和______。
(2)锌与盐酸反应速率可以通过观察_________进行判断,也可通过实验测定。通过实验测定锌与盐酸反应速率,除测量反应时间外,还需要测量的物理量是_______或 _____。
(3)为探究锌与盐酸反应过程的速率变化,某同学的实验测定方法是:在100ml稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(氢气体积已换算为标准状况):
时间/min | 1 | 2 | 3 | 4 | 5 |
体积/mL | 50 | 120 | 232 | 290 | 310 |
①哪一时间段反应速率最大_______(填“0~1 min”或“1~2 min”或“2~3 min”或“3~4 min”或“4~5min”)。
②2~3 min时间段以盐酸的浓度变化来表示的该反应速率(设溶液体积不变)为____________。
③试分析1~3min时间段里,反应速率变大的主要原因_________________________ 。
【答案】 温度 浓度 反应放出H2的快慢 锌的质量变化 生成氢气体积(合理答案均可) 2~3min反应速率最大 0.1mol.L-1.min-1 反应放热成为影响速率的主要因素
【解析】(1)当加热或加入浓盐酸后,反应速率明显加快,说明温度升高、浓度增大,可增大反应速率,则影响化学反应速率的因素有温度和浓度;
(2)锌与盐酸反应速率可以通过观察反应过程中气体冒出的气泡速率分析,观察反应放出氢气的快慢观察反应速率;通过实验测定锌与盐酸反应速率,除测量反应时间外,还需要测量的物理量是单位时间内物质质量变化,或其他体积变化,测定锌的质量变化,氢气的生成体积;
(3)①2~3min收集的气体的体积比其它时间段体积增大的大,则说明该时间段反应速率最大;
②2~3min时间段生成氢气体积为232ml-120mL=112mL,n(H2)= ![]() =0.005mol,则消耗n(HCl)=0.01mol,v=
=0.005mol,则消耗n(HCl)=0.01mol,v=![]() =
=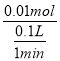 ==0.1mol·L-1·min-1;
==0.1mol·L-1·min-1;
③开始反应时浓度逐渐变小,温度逐渐升高,但反应速率逐渐增大,说明反应放热成为影响速率的主要因素。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
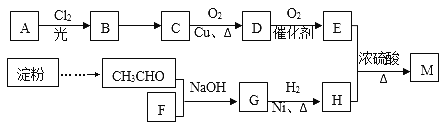
【题目】有机物M(C25H44O8)是一种新型治疗高血压病的药物,工业上用淀粉、烃A为基本原料合成M的路线如下图所示。
 已知:
已知:
I.烃A在质谱图中的最大质荷比为72,B分子中核磁共振氢谱有2个峰且面积比为9:2,35%-40%的F的水溶液被称为福尔马林。
II.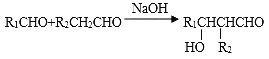
(1)A的名称为__________(系统命名法),B的结构简式为_______________,F的分子式为_____________;
(2)B→C的反应条件是______________,G的官能团名称是_____________;
(3)D与银氨溶液反应的方程式_____________________;
(4)E与H反应生成M的方程式___________________;
(5)E有多种同分异构体,其中能发生银镜反应且属于酯类的同分异构体共有____________种,其中核磁共振氢谱有2个峰的物质结构简式为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】T℃时在2L密闭容器中使X(g)与Y(g)发生反应生成Z(g),反应过程中X、Y、Z的物质的量变化如图1所示;若保持其他条件不变,温度分别为T1和T2,Y的百分含量与时间的关系如图2所示。下列分析不正确的是( )

A.容器中发生的反应可表示为:3X(g)+Y(g)2Z(g)
B. 0~3min内,v(X)=0.1 mol/(Lmin)
C.若改变条件,使反应进程如图3所示,则改变的条件可能是增大压强
D.达平衡后,升高温度,v正、v逆都增大,且再次平衡前v正>v逆
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)将锌片和银片浸入稀硫酸中组成原电池,两电极间连接一个电流表。
锌片上发生的电极反应:__________________;银片上发生的电极反应:_________________。
(2)若该电池中两电极的总质量为60 g,工作一段时间后,取出锌片和银片洗净干燥后称重,总质量为47 g,试计算:
①产生氢气的体积(标准状况)___________L;
②通过导线的电量________C。(已知NA=6.02×1023mol-1,电子电荷为1.60×10-19C)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“纳米材料”是粒子直径为1nm~100nm的材料,纳米碳就是其中的一种。某研究所将纳米碳均匀的分散到蒸馏水中,得到的物质:①是溶液②是胶体③具有丁达尔现象④具有吸附性⑤浊液。其中正确的是( )
A.②③④ B.②③⑤ C.①④⑥ D.①③④⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于金属铬的叙述中不正确的是( )
A. 铬元素在周期表中处于第四周期VIB族
B. 铬原子的外围电子层排布为3d44s2
C. 铬原子中,质子数为24
D. 铬元素位于元素周期表的d区,是过渡元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将10 mL 5 mol/L的HCl溶液稀释到200 mL,从中取出5 mL,这5 mL溶液的物质的量浓度为( )
A. 0.5 mol/L B. 0.25 mol/L C. 0.1 mol/L D. 1 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢溴酸在医药和石化工业上有广泛用途。下图是模拟工业制备氢溴酸粗品并精制的流程。
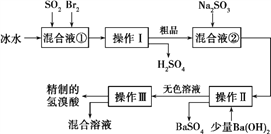
根据上述流程回答下列问题:
(1)混合液①中发生反应的化学方程式为________________________。
(2)溴与氯结合形成BrCl,BrCl的性质与卤素单质相似。则BrCl与水发生反应的化学方程式为___________________。
(3)加入Ba(OH)2反应的离子方程式为______________操作Ⅱ的名称是______。操作Ⅲ一般适用于分离______混合物。(选填编号)
a.固体和液体 b.固体和固体 c.互不相溶的液体 d.互溶的液体
(4)纯净的氢溴酸应为无色液体,但实际工业生产中制得的氢溴酸(工业氢溴酸)常带有淡淡的黄色。于是甲、乙两同学设计了简单实验加以探究:甲同学假设工业氢溴酸呈淡黄色是因为含有F![]() ,则用于证明该假设所用的试剂为______,反应的离子方程式为_____________。
,则用于证明该假设所用的试剂为______,反应的离子方程式为_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com