
| 8.8g |
| 44g/mol |
| 3.6g |
| 18g/mol |
| 0.2mol |
| 0.1mol |
| 0.2mol×2 |
| 0.1mol |
| 60-12×2-8 |
| 16 |
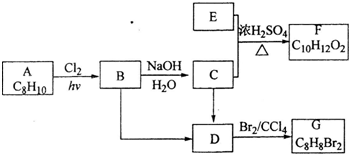
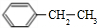 ,A与氯气在光照条件下发生取代反应生成B,而B中含有一个甲基,则B为
,A与氯气在光照条件下发生取代反应生成B,而B中含有一个甲基,则B为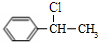 ,B发生水解反应生成C为
,B发生水解反应生成C为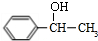 ,C与E发生酯化反应生成F,结合F的分子式可知,应是发生酯化反应,则E为CH3COOH,F为
,C与E发生酯化反应生成F,结合F的分子式可知,应是发生酯化反应,则E为CH3COOH,F为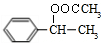 ,B、C转化都得到D,D与溴发生加成反应生成G,则B、C均发生消去反应生成D,故D为
,B、C转化都得到D,D与溴发生加成反应生成G,则B、C均发生消去反应生成D,故D为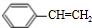 ,则G为
,则G为 ,据此解答.
,据此解答.| 8.8g |
| 44g/mol |
| 3.6g |
| 18g/mol |
| 0.2mol |
| 0.1mol |
| 0.2mol×2 |
| 0.1mol |
| 60-12×2-8 |
| 16 |
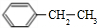 ,A与氯气在光照条件下发生取代反应生成B,而B中含有一个甲基,则B为
,A与氯气在光照条件下发生取代反应生成B,而B中含有一个甲基,则B为 ,B发生水解反应生成C为
,B发生水解反应生成C为 ,C与E发生酯化反应生成F,结合F的分子式可知,应是发生酯化反应,则E为CH3COOH,F为
,C与E发生酯化反应生成F,结合F的分子式可知,应是发生酯化反应,则E为CH3COOH,F为 ,B、C转化都得到D,D与溴发生加成反应生成G,则B、C均发生消去反应生成D,故D为
,B、C转化都得到D,D与溴发生加成反应生成G,则B、C均发生消去反应生成D,故D为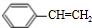 ,则G为
,则G为 ,
,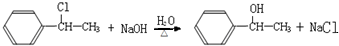 ,
,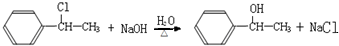 ;
; 发生消去反应生成
发生消去反应生成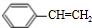 ,反应条件为:氢氧化钠醇溶液、加热,
,反应条件为:氢氧化钠醇溶液、加热, 发生消去反应生成
发生消去反应生成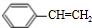 ,反应条件为:浓硫酸、加热,
,反应条件为:浓硫酸、加热, ,故答案为:
,故答案为: ;
; )的同分异构体中,苯环上一硝化的产物只有一种,对称性高,可以含有2个相同的取代基,且处于对位,为
)的同分异构体中,苯环上一硝化的产物只有一种,对称性高,可以含有2个相同的取代基,且处于对位,为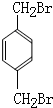 ,若含有3个取代基时,取代基不可能相同,苯环上取代至少有2种,故不可能含有3个取代基,可以可以4个取代基,为2个-Br、2个-CH3,分别为
,若含有3个取代基时,取代基不可能相同,苯环上取代至少有2种,故不可能含有3个取代基,可以可以4个取代基,为2个-Br、2个-CH3,分别为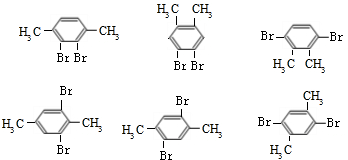 ,故符合条件的同分异构体共有7种,其中核磁共振氢谱有两组峰,且峰面积比为l:1的是
,故符合条件的同分异构体共有7种,其中核磁共振氢谱有两组峰,且峰面积比为l:1的是 ,
, .
.


科目:高中化学 来源: 题型:
| A、Br2+2I-=I2+2 Br- |
| B、2FeCl2+Cl2=2FeCl3 |
| C、2FeCl2+2HCl+I2=2FeCl3+2HI |
| D、2Fe3++2I-=2Fe2++I2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
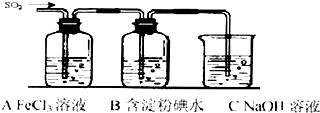
查看答案和解析>>
科目:高中化学 来源: 题型:
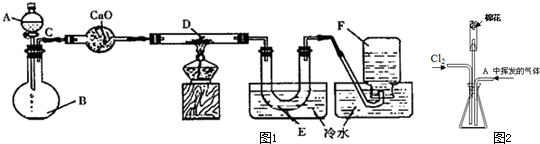
查看答案和解析>>
科目:高中化学 来源: 题型:
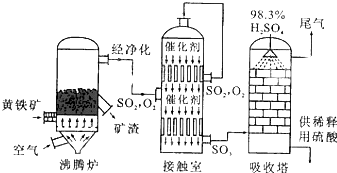 工业上常用硫磺矿或黄铁矿为原料生产硫酸,我国主要以黄铁矿为主,下面是用黄铁矿为原料生产硫酸的工艺流程图:
工业上常用硫磺矿或黄铁矿为原料生产硫酸,我国主要以黄铁矿为主,下面是用黄铁矿为原料生产硫酸的工艺流程图:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
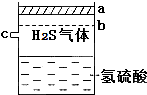 已知多元弱酸在水溶液中的电离是分步进行的,且第一步的电离程度大于第二步的电离程度,第二步的电离程度远大于第三步的电离程度…在密闭容器里盛有饱和H2S溶液和H2S气体,可上下移动的活塞停止在a处,如图所示.
已知多元弱酸在水溶液中的电离是分步进行的,且第一步的电离程度大于第二步的电离程度,第二步的电离程度远大于第三步的电离程度…在密闭容器里盛有饱和H2S溶液和H2S气体,可上下移动的活塞停止在a处,如图所示.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com