
| A. | ②④ | B. | ①③⑤ | C. | ①⑤⑥ | D. | ①④⑤ |
分析 ①pH=0的溶液,显酸性,离子之间发生氧化还原反应;
②pH=12的溶液,显碱性;
③水电离出的H+浓度c(H+)水=10-12mol•L-1的溶液,为酸或碱溶液;
④加入Mg能放出H2的溶液,显酸性;
⑤使甲基橙变红的溶液,显酸性;
⑥中性溶液不能存在Fe3+,且Fe3+、S2-发生氧化还原反应,Al3+、S2-发生相互促进水解反应.
解答 解:①pH=0的溶液,显酸性,Cl-、MnO4-发生氧化还原反应,不能共存,故不选;
②pH=12的溶液,显碱性,该组离子之间不反应,可大量共存,故选;
③水电离出的H+浓度c(H+)水=10-12mol•L-1的溶液,为酸或碱溶液,酸溶液中不能大量存在CO32-、NO3-、SO32-,且NO3-、SO32-发生氧化还原反应,故不选;
④加入Mg能放出H2的溶液,显酸性,该组离子之间不反应,可大量共存,故选;
⑤使甲基橙变红的溶液,显酸性,Fe2+、MnO4-发生氧化还原反应,不能共存,故不选;
⑥中性溶液不能存在Fe3+,且Fe3+、S2-发生氧化还原反应,Al3+、S2-发生相互促进水解反应,不能共存,故不选;
故选A.
点评 本题考查离子的共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重分析与应用能力的考查,注意复分解反应、氧化还原反应的判断,题目难度不大.


 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
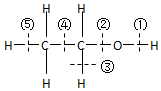
| A. | 和金属钠反应是键①断裂 | B. | 和浓硫酸共热到170℃时断键②和⑤ | ||
| C. | 和浓硫酸共热到140℃时仅断键② | D. | 和浓氢溴酸混合加热时断键② |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化碳与赤热的炭反应生成一氧化碳 | |
| B. | 葡萄糖在人体内氧化 | |
| C. | 生石灰制熟石灰 | |
| D. | Ba(OH)2•8H2O与NH4Cl反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁粉与稀硫酸反应:2Fe+6H+═2Fe3++3H2↑ | |
| B. | 用小苏打 (NaHCO3)治疗胃酸过多:HCO3-+H+═H2O+CO2↑ | |
| C. | 往碳酸镁中滴加稀盐酸:CO32-+2H+═H2O+CO2↑ | |
| D. | 氢氧化钡溶液与稀H2SO4反应:Ba2++SO42-+H++OH-═BaSO4↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入稀盐酸能产生无色气体,则一定有CO32- | |
| B. | 加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,则一定有Ag+ | |
| C. | 加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝,则一定有NH4+ | |
| D. | 加入碳酸钠溶液产生白色沉淀,再加盐酸,白色沉淀消失,则一定有Ca2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | t1时改变某一条件有如图所示变化,则改变的条件一定是加入催化剂 | |
| B. | 反应达到平衡时,外界条件对平衡影响关系如图所示,若b=1,a为正整数,则P1<P2 | |
| C. | 从加入反应物开始,物质的百分含量与温度关系如图所示,则该反应的正反应为吸热反应 | |
| D. | 反应速率和反应条件变化如图所示,则该反应正反应为放热反应,A、B一定是气体,D一定不是气体,C可能不是气体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com