
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:阅读理解
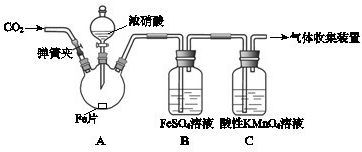
| 实验操作 | 实验现象 |
| 打开弹簧夹,通入一段时间CO2,关闭弹簧夹. | |
| 打开分液漏斗活塞,将浓硝酸缓慢滴入烧瓶中,关闭活塞. | 无明显现象. |
| 加热烧瓶,反应开始后停止加热. | ①A中有红棕色气体产生,一段时间后,气体颜色逐渐变浅; B中溶液变棕色; C中溶液紫色变浅. ②反应停止后,A中无固体剩余. |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
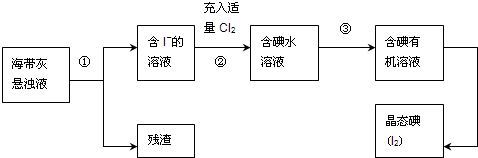
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解

| 实验步骤 | 实验现象 |
| I.向编号为①②③的3支试管中,分别加入1mL 20%的蔗糖溶液,向试管②和③中加入0.5mL稀硫酸,并将这3支试管同时水浴加热约5min | 均无明显现象 |
| II.取试管①和②,加入新制氢氧化铜悬浊液,加热至沸腾 | 均无明显现象 |
| III.取试管③,先加入NaOH溶液调溶液pH至碱性,再加入新制氢氧化铜悬浊液,加热至沸腾 | |
| 结论:证明蔗糖在稀硫酸作用下发生了水解反应 | |
| 产物 | 氢气 | 甲烷 | 乙烯 | 丙烯 | 苯 | 甲苯 | 碳 |
| 质量分数(%) | 12 | 24 | 12 | 16 | 20 | 10 | 6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
(13分)下面是甲、乙、丙三位同学制取乙酸乙酯的过程。
(1)甲、乙、丙三位同学均采取乙醇、冰醋酸与浓硫酸混合共热的方法制取乙酸乙酯,浓硫酸的作用是 ;
(2)甲、乙、丙三位同学分别设计了如图所示三套实验装置:
请从甲、乙两位同学设计的装置中选择一种作为实验室制取乙酸乙酯的装置,应选择的装置是 (选填“甲”或“乙”)。丙同学设计了丙装置,用球形干燥管代替玻璃管,除了起到冷凝作用外,另一重要作用是 。
(3)试管②中饱和Na2CO3的作用除了溶解乙醇、降低乙酸乙酯溶解度外,还可以 。
(4)从试管②中分离出乙酸乙酯的实验操作是 。
(5)生成乙酸乙酯的反应是可逆反应,反应物不能完全变成生成物,反应一段时间后,
就达到了该反应的限度,也即达到化学平衡状态。下列描述能说明乙醇与乙酸的酯化反
应已达到化学平衡状态的有(填序号) 。
①单位时间里,生成1mol乙酸乙酯,同时生成1mol水
②单位时间里,生成1mol乙酸乙酯,同时生成1mol乙酸
③单位时间里,消耗1mol乙醇,同时消耗1mol乙酸
④正反应的速率与逆反应的速率相等
⑤混合物中各物质的浓度不再变化
查看答案和解析>>
科目:高中化学 来源:2010—2011学年浙江省杭州师范大学附属中学高二上学期期末考试化学试卷 题型:实验题
(13分)下面是甲、乙、丙三位同学制取乙酸乙酯的过程。
(1)甲、乙、丙三位同学均采取乙醇、冰醋酸与浓硫酸混合共热的方法制取乙酸乙酯,浓硫酸的作用是 ;
(2)甲、乙、丙三位同学分别设计了如图所示三套实验装置: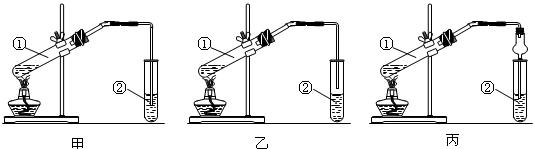 请从甲、乙两位同学设计的装置中选择一种作为实验室制取乙酸乙酯的装置,应选择的装置是 (选填“甲”或“乙”)。丙同学设计了丙装置,用球形干燥管代替玻璃管,除了起到冷凝作用外,另一重要作用是 。
请从甲、乙两位同学设计的装置中选择一种作为实验室制取乙酸乙酯的装置,应选择的装置是 (选填“甲”或“乙”)。丙同学设计了丙装置,用球形干燥管代替玻璃管,除了起到冷凝作用外,另一重要作用是 。
(3)试管②中饱和Na2CO3的作用除了溶解乙醇、降低乙酸乙酯溶解度外,还可以 。
(4)从试管②中分离出乙酸乙酯的实验操作是 。
(5)生成乙酸乙酯的反应是可逆反应,反应物不能完全变成生成物,反应一段时间后,
就达到了该反应的限度,也即达到化学平衡状态。下列描述能说明乙醇与乙酸的酯化反
应已达到化学平衡状态的有(填序号) 。
①单位时间里,生成1mol乙酸乙酯,同时生成1mol水
②单位时间里,生成1mol乙酸乙酯,同时生成1mol乙酸
③单位时间里,消耗1mol乙醇,同时消耗1mol乙酸
④正反应的速率与逆反应的速率相等
⑤混合物中各物质的浓度不再变化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com