
向2L密闭容器中通入a mol气体A和b mol气体B,在一定条件下发生反应:
xA(g)+yB(g)![]() pC(g)+qD(g) 已知:平均反应速率
pC(g)+qD(g) 已知:平均反应速率![]() ;反应2 min时A的浓度减少了a/6 mol/L,B的物质的量减少了
;反应2 min时A的浓度减少了a/6 mol/L,B的物质的量减少了![]() mol,有a mol D生成。
mol,有a mol D生成。
回答下列问题:
(1)反应2 min内,VA= ,vB=
(2)化学方程式中,x= y= p= q=
(3)反应达到平衡时,D为2a mol,则B的转化率为
(4)如果只升高反应温度,其他反应条件不变,平衡时D为1. 5a mol则该反应的
△H 0;(填“>、<或-”)
(5)如果其他条件不变,将容器的容积变为1L,进行同样的实验,则与上述反应比较:①反应速率 (填:“增大”“减小或“不变”)。 理由是_
②平衡时反应物的转化率 (填:“增大”“减小”或“不变”)理由是
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| a |
| 6 |
| a |
| 2 |
| a |
| 12 |
| a |
| 12 |
| a |
| 8 |
| a |
| 8 |
| a |
| b |
| a |
| b |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| 1 |
| 3 |
| a |
| 2 |
| a |
| 12 |
| a |
| 12 |
| a |
| 8 |
| a |
| 8 |
| a |
| b |
| a |
| b |
查看答案和解析>>
科目:高中化学 来源: 题型:
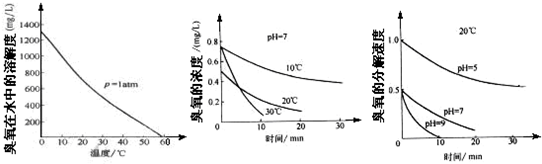
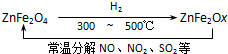
查看答案和解析>>
科目:高中化学 来源: 题型:
向2L密闭容器中通入amol 气体A和bmol气体B,在一定条件下发生反应:xA(g)+yB(g) ![]() pC(g)+qD(g)。
pC(g)+qD(g)。
已知:平均反应速率vC=1/2vA;反应2min 时,A的浓度减少了1/3,B的物质的量减少了a/2mol,有a mol D生成。
回答下列问题:
(1)化学方程式中,x= 、y= 、p= 、q= ;
(2)反应2min内,vA = ;
(3)反应平衡时,D为 2amol,则B的转化率为 ;
(4)已知该反应在不同温度下的平衡常数如下:
| 温度℃ | 1000 | 1150 | 1300 |
| 平衡常数 | 4.0 | 3.7 | 3.5 |
查看答案和解析>>
科目:高中化学 来源:2010年贵州册亨民族中学高二上学期期末考试化学卷(理) 题型:填空题
(4分) 合成氨工业对国民经济和社会发展具有重要的意义。向2L密闭容器中通入2mol 气体N2
和6mol气体H2,在一定条件下发生反应:N2(g)+3H2(g) 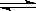 2NH3(g);已知:反应2min达到平衡 ,此时N2的浓度减少了2/3。
2NH3(g);已知:反应2min达到平衡 ,此时N2的浓度减少了2/3。
回答下列问题:
⑴反应2min内,用NH3表示该反应的速率是________________;
⑵反应平衡时,N2的转化率为 ;
⑶如果只升高反应温度,其他反应条件不变,平衡时NH3浓度为 1.1 mol/L,则该反应的ΔH 0;(填“>”、“<”或“=”)
⑷合成氨工业采取的下列措施中,不能用勒沙特列原理解释的是________(填序号)。
①20 MPa~50 MPa ②500℃的高温 ③铁触媒作催化剂
④将生成的氨液化并及时从体系中分离出来,未反应的N2、H2循环到合成塔中
⑸如果其他条件不变,将容器的容积变为 1L,进行同样的实验,则与上述反应比较:
反应速率 (填“增大”、“减小”或“不变”),理由是 ;
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com