

分析 周期表中的五种元素A、B、D、E、F,原子序数依次增大.A的基态原子价层电子排布为1snnsnnpn,s能级容纳2个电子,则A有6个电子,所以A为C元素;
B的基态原子2p能级有3个单电子,则B为N元素;D是一种富集在海水中的元素,含量位于海水中各元素的第三位,则D为Cl元素;E2+的3d轨道中有10个电子,为Zn,F位于第六周期,与Cu同族,其单质在金属活动性顺序表中排在末位,为Au元素,结合对应单质、化合物的性质以及元素周期率的递变规律解答该题.
解答 解:周期表中的五种元素A、B、D、E、F,原子序数依次增大.A的基态原子价层电子排布为1snnsnnpn,s能级容纳2个电子,则A有6个电子,所以A为C元素;
B的基态原子2p能级有3个单电子,则B为N元素;D是一种富集在海水中的元素,含量位于海水中各元素的第三位,则D为Cl元素;E2+的3d轨道中有10个电子,为Zn,F位于第六周期,与Cu同族,其单质在金属活动性顺序表中排在末位,为Au元素,
(1)基态Zn原子的价电子排布式为3d104s2,故答案为:3d104s2;
(2)A、B形成的CN-常作为配位化合物中的配体,CN-中C原子杂化轨道数目为1+$\frac{4+1-3}{2}$=2,C原子杂化方式为 sp杂化,CN-与氮气互为等电子体,C原子与N原子之间形成C≡N三键,含有的σ键与π键的数目之比为 1:2,
故答案为:sp;1:2;
(3)AuCl3是一种褐红色晶体,吸湿性极强,易溶于水和乙醇,无论是固态、还是气态,它都是以二聚体Au2Cl6的形式存在,依据以上信息判断AuCl3晶体的结构属于分子晶体,Au2Cl6的结构式为: ,
,
故答案为:分子; ;
;
(4)E为Zn,F为Au,工业上常用F和AB-形成的配离子与E反应来提取F单质,反应的离子放出为Zn+2[Au(CN)2]-=2Au+[Zn(CN)2]2-,
故答案为:Zn+2[Au(CN)2]-=2Au+[Zn(CN)2]2-;
(5)Au单质的晶体为面心立方最密堆积,则晶胞中含有Au原子个数为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,F单质的摩尔质量为Mg/mol,则晶胞的质量为$\frac{4M}{{N}_{A}}$,若Au的原子半径为anm,则晶胞的体积为(2$\sqrt{2}$×10-7a)cm3,阿伏加德罗常数为NA,Au单质的密度为ρ=$\frac{\frac{4M}{{N}_{A}}}{(2\sqrt{2}×1{0}^{-7}a)^{3}}$g/cm3=$\frac{1{0}^{21}M}{4\sqrt{2}{a}^{3}×{N}_{A}}$g/cm3,
故答案为:$\frac{1{0}^{21}M}{4\sqrt{2}{a}^{3}×{N}_{A}}$.
点评 本题考查物质结构和性质,为高频考点,涉及晶胞计算、等电子体、原子核外电子排布、第一电离能大小比较等知识点,侧重考查学生分析判断、计算、空间想象能力,难点是晶胞计算,注意(5)为易错点.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:实验题
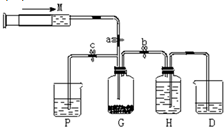 某课外活动小组利用如图所示装置制取氯气.提供的试剂有:浓盐酸、饱和食盐水,氢氧化钠溶液、高锰酸钾固体.反应的化学方程式为:2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O
某课外活动小组利用如图所示装置制取氯气.提供的试剂有:浓盐酸、饱和食盐水,氢氧化钠溶液、高锰酸钾固体.反应的化学方程式为:2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 冬天用煤炉取暖,为防止热量散失,应关紧门窗 | |
| B. | 进入古井前,应先做灯火试验 | |
| C. | 一次性塑料袋使用方便又经济,应大力提倡生产 | |
| D. | 油锅不慎着火,应立即用大量的水冲灭 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
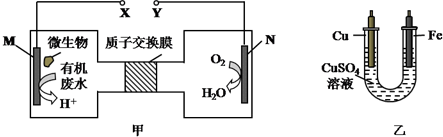
| A. | H+透过质子交换膜由左向右移动 | |
| B. | M电极反应式:H2NCONH2+H2O-6e-═CO2↑+N2↑+6H+ | |
| C. | 铁电极应与X相连接 | |
| D. | 当N电极消耗0.5mol气体时,则铁电极增重32g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2mol KClO3 | B. | 1mol KCl | C. | 1mol Ca(ClO)2 | D. | 2mol NaCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图,将锥形瓶置于水槽内,瓶中加入酒精.水槽中加入冷水后,再加入足量的下列物质,结果产生了酒精喷泉.水槽中加入的物质可以是( )
如图,将锥形瓶置于水槽内,瓶中加入酒精.水槽中加入冷水后,再加入足量的下列物质,结果产生了酒精喷泉.水槽中加入的物质可以是( )| A. | 生石灰 | B. | 食盐 | C. | 蔗糖 | D. | 固体NH4NO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
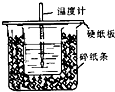 中和热的测量,是一个重要的定量实验.
中和热的测量,是一个重要的定量实验.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | +2.98 kJ•mol-1 | B. | -2.98 kJ•mol-1 | ||
| C. | +1807.98 kJ•mol-1 | D. | -1807.98 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向氯酸钾溶液中加入硝酸银溶液和稀硝酸,检验氯酸钾中的氯元素 | |
| B. | 铜可溶于浓硫酸却不溶于稀硫酸,证明浓硫酸的氧化性更强 | |
| C. | 氢氧化铝能分别跟强酸和强碱反应,说明氢氧化铝是两性氢氧化物 | |
| D. | 通过测溶液的pH,鉴别NH4Cl、NaCl、K2CO3三种溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com