
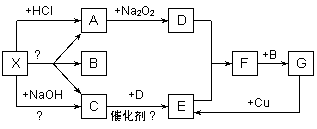
下图中每一个方框表示有关的一种反应物或生成物(部分生成物已省略),X是一种酸式盐,常用作化肥,加热分解生成A、B、C三种物质。其中A、C为无色气体,A能使澄清石灰水变浑浊,B在常温下是一种无色的液体。请填写下列空白:
(1)物质X的化学式是 ,
G的名称是 。
(2)X溶液与盐酸溶液反应的离子方程式是
。
(3)C→E的化学反应方程式是 。
(4)G与Cu反应的离子方程式是 。
科目:高中化学 来源: 题型:
观察下列几个装置示意图,有关叙述正确的是
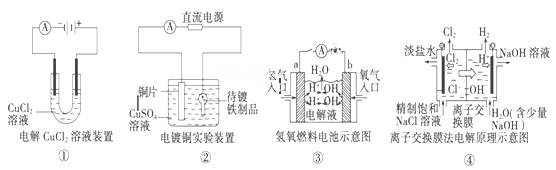
A.装置①中阳极上析出红色固体 B.装置②的待镀铁制品应与电源正极相连
C.装置③中外电路电子由a极流向b极
D.装置④中的离子交换膜允许阳离子、阴离子、水分子自由通过
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述Ⅰ和Ⅱ均正确并且有因果关系的是( )
| 选项 | 叙述I | 叙述II |
| A | 干燥的Cl2通入品红溶液中,品红褪色 | 干燥的Cl2具有漂白性 |
| B | NH4Cl受热易分解 | 用加热法除去 NaCl中的NH4Cl |
| C | Na2O2使酚酞溶液变红 | Na2O2使品红溶液褪色 |
| D | CaCO3难溶于水 | CO2通入CaCl2溶液中产生白色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
关于氢键的下列说法中正确的是( )
A.每个水分子内含有两个氢键
B.在水蒸气、水和冰中都含有氢键
C.HF的稳定性很强,是因为其分子间能形成氢键
D.分子间能形成氢键使物质的熔点和沸点升高
查看答案和解析>>
科目:高中化学 来源: 题型:
铅蓄电池是广泛应用于汽车、柴油机车等的启动电源。产生电能时的电极反应分别为:
Pb+SO42―–2e―=PbSO4 ①
PbO2+4H++SO42―+2e―=PbSO4+2H2O ②
下列有关铅蓄电池的说法不正确的是: ( )
A.①式表示负极反应,②式表示正极反应
B.铅蓄电池的电解质溶液是硫酸溶液,在放电过程中,它的浓度逐渐降低
C.铅蓄电池在放电时,电子从Pb通过导线流向PbO2
D.铅蓄电池在充电时,原来负极发生的反应是:Pb+SO42―–2e―=PbSO4
查看答案和解析>>
科目:高中化学 来源: 题型:
有机物X的蒸气相对氢气的密度为51,X中氧元素的质量分数为31.7%,则能在碱性溶液中发生反应的X的同分异构体有(不考虑立体异构)( )
A.15种 B.14种 C.13种 D.12种
查看答案和解析>>
科目:高中化学 来源: 题型:
合成氨是人类研究的重要课题,目前工业合成氨的原理为:
合成氨是人类研究的重要课题,目前工业合成氨的原理为:
N2(g)+3H2(g) 2NH3(g)△H=-93.0kJ•mol-1,在3个2L的密闭容器中,使用相同的催化剂,按不同方式投入反应物,分别进行反应:
2NH3(g)△H=-93.0kJ•mol-1,在3个2L的密闭容器中,使用相同的催化剂,按不同方式投入反应物,分别进行反应:
相持恒温、恒容,测的反应达到平衡时关系数据如下:
| 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 3molH2、2molN2 | 6molH2、4molN2 | 2mol NH3 |
| 达到平衡的时间/min | 6 | 8 | |
| 平衡时 N2的体积密度 | C1 | 1.5 | |
| 混合气体密度/g·L-1 |
|
| |
| 平衡常数/ L2·mol-2 | K甲 | K乙 | K丙 |
(1)下列各项能说明该反应已到达平衡状态的是 (填写序号字母)
a.容器内H2、N2 、NH3的浓度只比为1:3:2 b.容器内压强保持不变
c.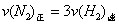 d.混合气体的密度保持不变
d.混合气体的密度保持不变
e.混合气体的平均相对分子质量不变
(2)容器乙中反应从开始到达平衡的反应速度为 =
=
(3)在该温度下甲容器中反应的平衡常数K (用含C1的代数式表示)
(4)分析上表数据,下列关系正确的是 (填序号):
a. b.
b. c.
c. 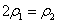 d.
d.
(5)另据报道,常温、常压下,N2在掺有少量氧化铁的二氧化钛催化剂表面能与水发生反应,生成NH3和O2。已知:H2的燃烧热△H=-286KJ/mol,则由次原理制NH3反应的热化学方程式为
(6)希腊阿里斯多德大学的George Mamellos和Michacl Stoukides,发明了一种合成氨的新方法,在常压下,把氢气和用氨气稀释的氮气分别通入一个加热到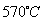 的电解池,李勇能通过的氢离子的多孔陶瓷固体作电解质,氢气和氮气在电极上合成了氨,转化率达到78%,在电解法合成氨的过程中,应将H2不断地通入 极,该电极反应式为 。
的电解池,李勇能通过的氢离子的多孔陶瓷固体作电解质,氢气和氮气在电极上合成了氨,转化率达到78%,在电解法合成氨的过程中,应将H2不断地通入 极,该电极反应式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
氯元素在自然界有35Cl和37Cl两种同位素,在计算式34.969×75.77%+36.966×24.23% =35.453中
A.75.77%表示35Cl的质量分数
B.24.23%表示35Cl的原子百分含量
C.35.453表示氯元素的相对原子质量
D.36.966表示37Cl的质量数
查看答案和解析>>
科目:高中化学 来源: 题型:
有7种物质:①甲烷;②苯;③聚乙烯;④乙烯;⑤己烷;⑥甲苯;⑦环己烯。因为发生化学反应,既能使酸性高锰酸钾溶液褪色又能与溴水褪色的是
A.③④⑦ B.④⑤⑦ C. ④⑦ D. ④⑥⑦
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com