
| 弱电解质化学式 | CH3COOH | HCN | H2CO3 | NH3.H2O |
| 电离平衡常数 | 1.8×l0-5 | 4.9×l0-10 | K1=4.3×l0-7K2=5.6×l0-11 | 1.8×l0-5 |


科目:高中化学 来源: 题型:
| A、医用酒精是用淀粉类植物发酵经蒸馏制成,浓度通常是75% |
| B、福尔马林可浸制标本,利用了其使蛋白质变性的性质 |
| C、“海水淡化”可以解决“淡水供应危机”,向海水中加入净水剂明矾可以使海水淡化 |
| D、绚丽缤纷的烟花中添加了含钾、钠、钙、铜等金属元素的化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、正极发生还原反应 |
| B、通入CH4的电极为负极 |
| C、该电池使用一段时间后应补充KOH |
| D、燃料电池工作时,溶液中的OH-向正极移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CH3COOH与CH3COO-的浓度之和减小为原来的0.1 |
| B、CH3COO-与CH3COOH的浓度之比增大为原来的10倍 |
| C、CH3COO-与H+的浓度之积减小为原来的0.1 |
| D、CH3COOH的电离平衡常数增大为原来的10倍 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、z=4 | ||
| B、B的转化率是40% | ||
| C、A的平衡浓度是1.4 mol?L-1 | ||
D、平衡时气体压强是原来的
|
查看答案和解析>>
科目:高中化学 来源: 题型:
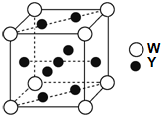 已知:W、X、Y、Z四种元素原子序数依次减小.其中:
已知:W、X、Y、Z四种元素原子序数依次减小.其中:| 电离能/(kJ?mol-1) | I1 | I2 | I3 | I4 | I5 |
| Y | 584 | 1823 | 2751 | 11584 | 14837 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、开发太阳能、水能、风能、可燃冰等新能源,减少使用煤、石油等化石燃料 |
| B、将煤进行气化处理,提高煤的综合利用效率 |
| C、大量开采煤、石油,提高产量以满足工业生产的快速发展 |
| D、实现资源的“3R”利用观,即:减少资源消耗(Reduce)、增加资源的重复使用(Reuse)、资源的循环再生(Recycle) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com