
【题目】(1)苯和溴的取代反应的实验装置如图所示,其中A为具支试管改制成的反应容器,在其下端开了一小孔,塞好石棉绒,再加入少量铁屑。
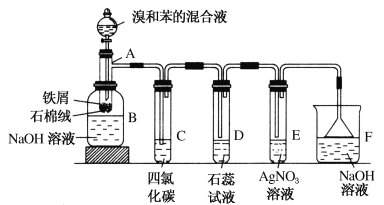
填写下列空白:
①试管A中的反应方程式为_______________。
②试管C中四氯化碳的作用是:____________。反应开始后,观察D和E两试管,看到的现象为:_________________。写出E中反应的离子方程式_____________________。
③在上述整套装置中,具有防倒吸功能的仪器有_____(填字母)。
(2)实验室制备硝基苯的主要步骤如下:
a. 配制一定比例的浓H2SO4与浓HNO3的混合酸,加入反应器中;
b. 向室温下的混合酸中逐滴加入一定量的苯,充分振荡,混合均匀;
c. 在55~60 ℃下发生反应,直至反应结束;
d .除去混合酸后,粗产品依次用蒸馏水和5%NaOH溶液洗涤,最后再用蒸馏水洗涤;
e. 将用无水CaCl2干燥后的粗硝基苯进行蒸馏,得到纯净硝基苯。
请填写下列空白:
①制备硝基苯的反应类型是________。
②配制一定比例的浓H2SO4和浓HNO3的混合酸时,操作的注意事项是:___________。
③步骤d中洗涤、分离粗硝基苯应使用的仪器是___________________。
④步骤d中粗产品用5%NaOH溶液洗涤的目的是______________________。
【答案】![]() 除去HBr气体中混有的溴蒸气 D试管中石蕊试液慢慢变红,并在导管口有白雾产生,然后E试管中出现浅黄色沉淀 Ag++Br-=AgBr↓ D、E、F 取代反应 先将浓HNO3注入容器中,再慢慢注入浓H2SO4,并及时搅拌 分液漏斗 除去粗产品中残留的酸
除去HBr气体中混有的溴蒸气 D试管中石蕊试液慢慢变红,并在导管口有白雾产生,然后E试管中出现浅黄色沉淀 Ag++Br-=AgBr↓ D、E、F 取代反应 先将浓HNO3注入容器中,再慢慢注入浓H2SO4,并及时搅拌 分液漏斗 除去粗产品中残留的酸
【解析】
(1)在A中,苯与液溴在Fe催化作用下发生取代反应产生溴苯和HBr,反应后的液体进入广口瓶B中,NaOH能够与未反应的Br2反应产生易溶于水的物质,而与有机物溴苯及苯分离;装置C能够溶解除去挥发的未反应的溴,反应产生的HBr溶于装置D中的石蕊试液中,得到氢溴酸具有酸性,可以使石蕊试液变为红色;HBr溶于AgNO3溶液,二者发生复分解反应产生AgBr浅黄色沉淀;由于HBr是大气污染物,所以尾气经装置F中用NaOH溶液进行处理后再进行排放,由于HBr极易溶于水,防止产生倒吸现象,在装置D、E、F中导气管都在液面上,就可以避免倒吸现象的发生。
(2)苯与浓硝酸在浓硫酸作催化剂条件下加热50~60℃,发生取代反应产生硝基苯和H2O。由于浓硝酸与浓硫酸混合时会放出大量热,结合硫酸密度比硝酸大,应该向盛有浓硝酸的装置中缓缓加入浓硫酸,并不断搅拌,待混合酸冷却后,再向其中加入苯,然后水浴加热50~60℃发生反应制取硝基苯,直至反应结束。反应结束后的混合液中含有未反应的硝酸、催化剂硫酸及反应产物硝基苯,这些物质在室温下都呈液态,有机物与酸液互不相溶,所以除去粗产品中的酸,可以先用大量水洗,经分液后,再用5%的NaOH溶液洗涤,最后用蒸馏水洗涤。分离互不相溶的液态物质,采取分液操作,需要使用的仪器是分液漏斗。
(1)①试管A中液溴与苯在催化剂Fe催化作用下发生取代反应产生溴苯和HBr,反应的化学方程式为:![]() ;
;
②溴与苯的反应是放热反应,使反应产生的HBr气体中含有挥发的未反应的溴和苯。溴和苯易溶于有机溶剂四氯化碳中,而HBr在四氯化碳中不能溶解,所以试管C中四氯化碳的作用是除去HBr气体中混有的溴蒸气和苯,防止Br2蒸气对HBr气体的检验产生干扰。反应开始后,会观察到在试管D中石蕊试液慢慢变为红色,并在导管口产生白雾;在试管E中产生了浅黄色沉淀,发生该反应的离子方程式为:Ag++Br-=AgBr↓;
③HBr极易溶于水,为防止因HBr的溶解而产生的倒吸现象,在装置中采用了具有防倒吸功能的有D、E、F;
(2)①苯与浓硝酸在浓硫酸作催化剂条件下发生取代反应产生硝基苯和水,所以制备硝基苯的反应类型是取代反应;
②浓硝酸与浓硫酸混合时会放出大量热,由于浓硫酸密度比浓硝酸大,所以在配制一定比例的浓H2SO4和浓HNO3的混合酸时,要向盛有浓硝酸的装置中沿器壁缓缓加入浓硫酸,并不断搅拌,使热量迅速扩散;
③硝基苯是密度比水大,难溶于水的液体,所以在步骤d中洗涤、分离粗硝基苯就是要分离互不相溶的两层液体物质,使用的分离方法是分液,应使用的仪器是分液漏斗;
④步骤d中粗产品用5%NaOH溶液洗涤的目的是除去粗产品中残留的酸。


科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 增大压强或升高温度,—定能使化学反应速率加快
B. 己知 Ni(CO)4(g)=Ni(s)+4CO(g) △H=QkJ/mol,则 Ni(s) +4CO(g)=Ni(CO)4(g) △H=-QkJ/mol
C. 500°C、30 MPa下, 0.5 mol N2(g)和1.5mol H2(g)反应生成NH3(g) 放热QkJ,其热化学方程式为N2(g)+3 H2(g)![]() 2 NH3(g) △H=-2QkJ/mol
2 NH3(g) △H=-2QkJ/mol
D. 己知两个平衡体系:2NiO(s)![]() 2Ni(s)+O2(g) 2CO(g)+O2(g)
2Ni(s)+O2(g) 2CO(g)+O2(g)![]() 2CO2(g)是平衡常数分别为K1和K2,可推知平衡NiO(s)+CO(g)
2CO2(g)是平衡常数分别为K1和K2,可推知平衡NiO(s)+CO(g)![]() Ni(s)+CO2(g)的平衡常数为
Ni(s)+CO2(g)的平衡常数为![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求完成下列问题:
![]()
(1)A、B、C之间有如图的转化关系,若A为AlCl3,写出A和C反应的离子方程式:_______________;
(2)检验Na2SO4和NaCl混合溶液中的Cl-的方法是:向少量混合液中加入足量a溶液,充分震荡后静置,然后取上层清液于试管中,再加入几滴b溶液,产生白色沉淀。试剂a、b分别是_____________ 、_______________
(3)已知H2、CO的燃烧热分别是akJ∕mol、bkJ∕mol,1mol液态水变为气态水吸收ckJ热量,C(s) + H2O(g)= CO(g)+ H2(g)△H=dkJ∕mol,写出碳(C)燃烧的热化学方程式____________________。
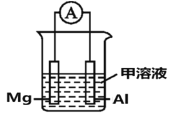
(4)Mg、Al设计成如图所示原电池装置:若电解液为盐酸,正极的电极反应为__________。若电解液为氢氧化钠溶液,负极的电极反应为________________。
(5)写出用氢氧化钾做电解质溶液,甲醇(CH3OH)为燃料的负极的电极反应:__________________。
(6)若铅蓄电池负极质量增加19.2g,则其正极质量增加____________ g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
已知:2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJmol-1
2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l) ΔH=-1452 kJmol-1
H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJmol-1
A.H2(g)的燃烧热为571.6 kJmol-1
B.同质量的H2(g)和CH3OH(l)完全燃烧,H2(g)放出的热量多
C.H2SO4(aq)+Ba(OH)2(aq)=BaSO4(s)+H2O(l) ΔH=-57.3 kJmol-1
D.3H2(g)+CO2(g)=CH3OH(l)+H2O(l) ΔH=+135.9 kJmol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温时,CaCO3在水中的沉淀溶解平衡曲线如图所示。已知CaCO3的溶度积(室温)为2.8×10-9,下列说法中不正确的是
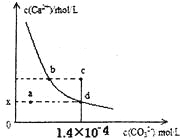
A. x的数值为2×10-5
B. c点时有CaCO3生成
C. 加入蒸馏水可使溶液由d点变成 a点
D. b点与d点对应的溶度积相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回答下列问题:
(1)泡沫灭火器原理(用离子方程式表示)___________
(2)碳酸钠溶液蒸干灼烧得到的固体是_____, 原因是____________
(3)已知NaHR溶液中c(H2R)<c(R2-),则该溶液中c(H+)________c(OH-)(填写“<”或“=”或“>”)
(4)相同条件下,同浓度的NH3H2O , NH4Cl,NH4Al(SO4)2,NH4HSO4水溶液,NH4+浓度分别为a,b,c,d,则几种物质NH4+浓度由大到小的顺序为_______ (用a,b,c,d,表示)
(5)二氯亚砜(SOCl2)是一种无色易挥发液体,与水剧烈水解生成两种气体,常做脱水剂。用硫磺(用S表示)、液氯和三氧化硫为原料在一定条件下合成二氯亚砜,原子利用率达到百分之百,则三者的物质的量之比为____________ 写出SOCl2吸收水蒸气的化学方程式___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究CO2的利用对促进低碳社会的构建具有重要的意义。
(1)将燃煤废气中的CO2转化为二甲醚的反应原理为:2CO2(g)+ 6H2(g) ![]() CH3OCH3(g) + 3H2O(l),该反应化学平衡常数表达式K = ________________________。
CH3OCH3(g) + 3H2O(l),该反应化学平衡常数表达式K = ________________________。
(2)已知在某压强下,该反应在不同温度、不同投料比时,达平衡时CO2的转化率如图

①该反应的ΔH ________ 0(填“>"或“<”)。
②若温度不变,减小反应投料比[n(H2)/n(CO2)],K值将________(填“增大”、“减小”或“不变”)。
(3)某温度下,向体积一定的密闭容器中通入CO2(g)与H2(g)发生上述反应,下列物理量不再发生变化时,能说明反应达到平衡状态的是__________。
A.混气的颜色 B.容器中的压强
C.气体的密度 D.CH3OCH3与H2O的物质的量之比
(4)某温度下,在体积可变的密闭容器中,改变起始时加入各物质的量,在不同的压强下,平衡时CH3OCH3(g)的物质的量如下表所示:
P1 | P2 | P3 | |
I.2.0 mol CO2 6.0 mol H2 | 0.10 mol | 0.04 mol | 0.02 mol |
II.1.0 mol CO2 3.0 mol H2 | X1 | Y1 | Z1 |
III.1.0 mol CH3OCH3 3.0 mol H2O | X2 | Y2 | Z2 |
①P1 ________ P3(填“>”“<”或“=”);
②P2下,III中CH3OCH3的平衡转化率为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列实验装置(部分夹持装置略去)进行相应的实验,能达到实验目的的是 ( )
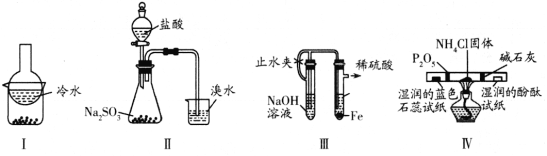
A. 加热装置I中的烧杯分离I2和高锰酸钾固体
B. 用装置II验证二氧化硫的漂白性
C. 用装置III制备氢氧化亚铁沉淀
D. 用装置IV检验氯化铵受热分解生成的两种气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物F是一种重要的有机合成中间体,它的合成路线如图:
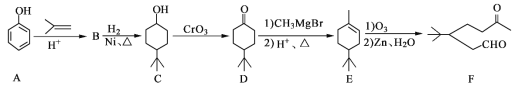
(1)化合物F中含氧官能团的名称是______和______,由A生成B的化学反应类型是______;
(2)写出化合物B的结构简式:______;
(3)写出化合物C与乙酸反应生成酯的化学方程式:______;
(4)某化合物是D的同分异构体,且分子中只有三种不同化学环境的氢。写出该化合物的结构简式:______(任写一种);
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com