
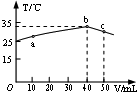
| A. | HA溶液的物质的量浓度为0.01mol/L | |
| B. | a→b的过程中,混合溶液中可能存在:c(A-)=c(Na+) | |
| C. | b→c的过程中,温度降低的主要原因是溶液中A-发生了水解反应 | |
| D. | 25℃时,HA的电离平衡常数K约为1.25×10-3 |
分析 A.恰好中和时混合溶液温度最高,即b点,此时消耗氢氧化钠0.04mol,计算氢氧化钠物质的量和酸物质的量相同计算得出HA的浓度;
B.NaA呈碱性,HA呈酸性,a→b的过程中,混合溶液中可能呈中性,依据电荷守恒分析;
C.b→c的过程中,温度降低的原因是溶液中发生了反应恰好生成NaA,继续滴加氢氧化钠溶液不再发生反应;
D.电离平衡常数K=$\frac{c({A}^{-}).c({H}^{+})}{c(HA)}$计算得到判断.
解答 解:A.恰好中和时混合溶液温度最高,即b点,此时消耗氢氧化钠=0.04L×1mol/L=0.04mol,得出50mlHA的浓度=$\frac{0.04mol}{0.05L}$=0.8mol/L,故A错误;
B.NaA呈碱性,HA呈酸性,a→b的过程中,混合溶液中可能呈中性,存在:c(A-)=c(Na+),故B正确;
C.b→c的过程中,温度降低的原因是溶液中发生了反应恰好生成NaA,继续滴加氢氧化钠溶液不再发生反应,溶液温度降低,故C错误;
D.电离平衡常数K=$\frac{c({A}^{-}).c({H}^{+})}{c(HA)}$=$\frac{0.001×0.001}{0.8}$=1.25×10-6,故D错误;
故选B.
点评 本题考查酸碱混合溶液定性判断,为偏高考点,侧重考查学生分析计算能力,知道酸碱混合过程中溶液温度变化原因及曲线变化及拐点含义,难点是电离平衡常数的计算.


 全优点练单元计划系列答案
全优点练单元计划系列答案科目:高中化学 来源: 题型:选择题
| A. | 负极反应为:14H2O+7O2+28e-=28OH- | |
| B. | 放电一段时间后,负极周围的pH升高 | |
| C. | 放电过程中OH-向正极移动 | |
| D. | 每消耗1mol C2H6,则电路上转移的电子为14mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
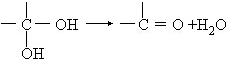
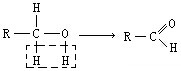
 (在方框中填写有机物的结构简式,说明加氧氧化)
(在方框中填写有机物的结构简式,说明加氧氧化)查看答案和解析>>
科目:高中化学 来源: 题型:解答题
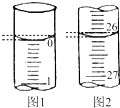 某学生用已知物质的量浓度的盐酸来测定未知物质的量浓度的氢氧化钠溶液(盛放于锥形瓶中)时,选择酚酞作指示剂,请填写下列空白:
某学生用已知物质的量浓度的盐酸来测定未知物质的量浓度的氢氧化钠溶液(盛放于锥形瓶中)时,选择酚酞作指示剂,请填写下列空白:| 滴定次数 | 0.1000mol-L-1盐酸的体积/mL | ||
| 滴定前 | 滴定后 | 体积/mL | |
| 1 | 0.10 | 26.21 | 26.11 |
| 2 | 1.56 | 31.30 | 29.74 |
| 3 | 0.22 | 26.31 | 26.09 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 打开反应釜,将Na 暴露在空气中与氧气反应 | |
| B. | 向反应釜通入Cl2,Na 在Cl2中燃烧生成NaCl | |
| C. | 向反应釜加大量H2O,通过化学反应“除掉”金属钠 | |
| D. | 向反应釜滴加C2H5OH,并设置放气管,排出氢气和热量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com