
往100 mL的NaOH溶液中通入CO2充分反应后,在减压和较低温度下,小心地将溶液蒸干,得到白色固体M。通入的CO2的体积V(标准状况)与M的质量(W)的关系如图所示。
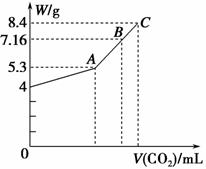
试解答下列问题:
(1)A点时,白色固体M的化学式为________,通入标准状况下的CO2的体积为________ mL。
(2)C点时,白色固体M的化学式为________,通入标准状况下的CO2的体积为________ mL。
(3)B点时M的组成成分为________(用化学式表示),通入的标准状况下的CO2的体积为________ mL。
(4)该NaOH溶液的物质的量浓度为________。
(5)如何检验B点溶液中的阴离子?
解析 本题考查了CO2与NaOH反应时产物与通入CO2量之间的关系,向NaOH溶液中逐渐通入CO2至过量发生的反应为CO2+2NaOH===Na2CO3+H2O,CO2+H2O+Na2CO3===2NaHCO3。由图可知NaOH的质量为4 g,n(NaOH)=0.1 mol,c(NaOH)=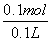 =1 mol·L-1。NaOH完全转化为Na2CO3时,m(Na2CO3)=5.3 g,A点为Na2CO3,V(CO2)=
=1 mol·L-1。NaOH完全转化为Na2CO3时,m(Na2CO3)=5.3 g,A点为Na2CO3,V(CO2)=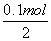 ×22.4 L·mol-1=
×22.4 L·mol-1=
1.12 L=1 120 mL。完全转化为NaHCO3时,m(NaHCO3)=8.4 g,C点为NaHCO3,V(CO2)=0.1 mol×22.4 L·mol-1=2.24 L=2 240 mL,因B点时M质量为7.16 g,5.3<7.16<8.4,知M为Na2CO3和NaHCO3的混合物。设B点时Na2CO3的物质的量为x,NaHCO3的物质的量为y,则有:2x+y=0.1 mol,106 g·mol-1×x+84 g·mol-1×y=7.16 g,解得x=0.02 mol,y=0.06 mol,所以V(CO2)=(0.02+0.06) mol×22.4 L·mol-1×1 000 mL·L-1=1 792 mL。在B点时溶液中含有CO 、HCO
、HCO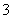 。
。
答案 (1)Na2CO3 1 120
(2)NaHCO3 2 240
(3)Na2CO3、NaHCO3 1 792
(4)1 mol·L-1 (5)在B点时溶液中含有CO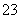 、HCO
、HCO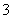 。
。
CO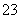 的检验:取样,加入BaCl2溶液,产生白色沉淀。过滤,向白色沉淀滴加盐酸产生能使澄清石灰水变浑浊的无色无味气体,说明含有CO
的检验:取样,加入BaCl2溶液,产生白色沉淀。过滤,向白色沉淀滴加盐酸产生能使澄清石灰水变浑浊的无色无味气体,说明含有CO ;HCO
;HCO 的检验:取样,滴加盐酸产生能使澄清石灰水变浑浊的无色无味气体,说明含有HCO
的检验:取样,滴加盐酸产生能使澄清石灰水变浑浊的无色无味气体,说明含有HCO 。
。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
下列关于有机物的说法错误的是
A.CCl4可由CH4制得,可萃取碘水中的碘
B.石油和天然气的主要成分都是碳氢化合物
C.乙醇、乙酸和乙酸乙酯能用饱和Na2CO3溶液鉴别
D.苯不能使KMnO4溶液退色,因此苯不能发生氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
氯在饮用水处理中常用作杀菌剂,且HClO的杀菌能力比 ClO-强。25 ℃时氯气-氯水体系中存在以下平衡关系:
Cl2(g)Cl2(aq) K1=10-1.2
Cl2(aq)+H2OHClO+H++Cl-K2=10-3.4
HClOH++ClO-Ka=?
其中Cl2(aq)、HClO和ClO-分别在三者中所占分数(α)随pH变化的关系如图所示。下列表述正确的是 ( )。
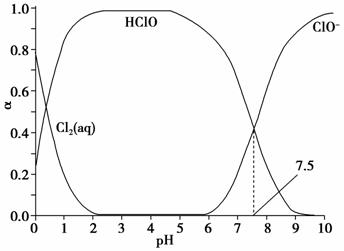
A.Cl2(g)+H2O2H++ClO-+Cl- K=10-10.9
B.在氯处理水体系中,c(HClO)+c(ClO-)=c(H+)-c(OH- )
C.用氯处理饮用水时,pH=7.5时杀菌效果比pH=6.5时差
D.氯处理饮用水时,在夏季的杀菌效果比在冬季好
查看答案和解析>>
科目:高中化学 来源: 题型:
如图是向MgCl2、AlCl3混合液中依次加入M和N时生成沉淀的物质的量与加入的M和N的体积关系图(M、N分别表示盐酸或氢氧化钠溶液中的一种),以下结论不正确的是 ( )。
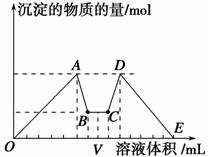
A.混合溶液中c(AlCl3)∶c(MgCl2)=1∶1
B.混合溶液中c(AlCl3)∶c(MgCl2)=3∶1
C.点V之前加NaOH溶液,点V之后加盐酸
D.所加盐酸与NaOH溶液中溶质的物质的量浓度相同
查看答案和解析>>
科目:高中化学 来源: 题型:
2.8 g Fe全部溶于一定浓度、200 mL 的HNO3溶液中,得到标准状况下的气体1.12 L,测得反应后溶液的pH为1。若反应前后溶液体积变化忽略不计,则下列有关判断正确的是 ( )。
A.反应后溶液中c(NO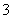 )=0.80 mol·L-1
)=0.80 mol·L-1
B.反应后的溶液最多还能溶解1.82 g Fe
C.反应前HNO3溶液的浓度为1.0 mol·L-1
D.1.12 L气体是NO、NO2的混合气体
查看答案和解析>>
科目:高中化学 来源: 题型:
硝酸铜是一种重要的工业产品,化学上有很多方法可以制取硝酸铜:①将铜溶于硝酸中、②先将铜与O2反应生成CuO,再溶于硝酸中、③将铜溶于N2O4的乙酸乙酯(溶剂,不参加反应)溶液中生成硝酸铜和一氧化氮。下列认识或判断错误的是 ( )。
A.方法③是最经济和环保的
B.方法①中,若从经济和环保的角度考虑,用稀硝酸比用浓硝酸好
C.方法②需要消耗能源,对环境不产生污染
D.方法③中N2O4既是氧化剂又是还原剂
查看答案和解析>>
科目:高中化学 来源: 题型:
合金是建造航空母舰的主体材料。
(1)航母升降机可由铝合金制造。
①铝元素在周期表中的位置为_________________________,
工业炼铝的原料由铝土矿提取而得,提取过程中通入的气体为______________。
②Al-Mg合金焊接前用NaOH溶液处理Al2O3膜,其化学方程式为____________________。焊接过程中使用的保护气为__________________(填化学式)。
(2)航母舰体材料为合金钢。
①舰体在海水中发生的电化学腐蚀主要为___________________________ _____________________________________________。
②航母用钢可由低硅生铁冶炼而成,则在炼铁过程中为降低硅含量需加入的物质为______________。
(3)航母螺旋浆主要用铜合金制造。
①80.0 g Cu-Al合金用酸完全溶解后,加入过量氨水,过滤得白色沉淀39.0 g,则合金中Cu的质量分数为________________________。
②为分析某铜合金的成分,用酸将其完全溶解后,用NaOH溶液调节pH,当pH=3.4时开始出现沉淀,分别在pH为7.0、8.0时过滤沉淀。结合下图信息推断该合金中除铜外一定含有____________________。
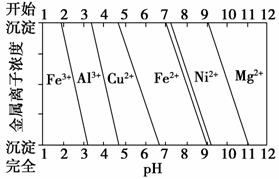
查看答案和解析>>
科目:高中化学 来源: 题型:
有一块镁铝合金,其中镁与铝的质量比是8∶9。加入足量稀H2SO4使其完全溶解后,再加入NaOH溶液,生成沉淀的质量随NaOH溶液体积变化的曲线如下图,其中正确的是 ( )。
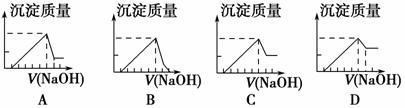
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com