
【题目】把镁条投入盛有盐酸的敞口容器中,产生氢气的速率变化如图所示.下列因素中,可能影响该反应的反应速率的因素是( )
①盐酸的浓度 ②镁条的表面积③溶液的温度 ④Cl﹣的浓度.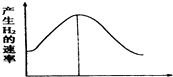
A.①④
B.③④
C.①②③
D.②③
【答案】C
【解析】解:因图中生成氢气的反应速率先增大后减小,发生的反应为Mg+2H+═Mg2++H2↑,①开始盐酸的浓度较大,反应速率加快,但随反应的进行,浓度减小,则反应速率减小,故①正确;
②由反应可知Mg参加反应,开始接触面积大,反应速率快,但随反应的进行,接触面积减小,则反应速率减小,故②正确;
③因该反应为放热反应,放热使温度升高,则反应速率加快,但随反应的进行,反应变慢,放出的热量减小,温度降低,则反应速率减小,故③正确;
④因Cl﹣不参加反应,Cl﹣的浓度增大或减小都不影响化学反应速率,且该反应中Cl﹣的浓度不变,故④错误;
即影响反应速率的因素为①②③,故选C.
由图可知,生成氢气的反应速率先增大后减小,利用反应实质Mg+2H+═Mg2++H2↑及影响反应速率的因素来分析.


科目:高中化学 来源: 题型:
【题目】有A、B、C三种常见的金属单质,A在空气中燃烧生成淡黄色固体;B也能在空气中剧烈燃烧,发出耀眼的白光;C在一定条件下与水蒸气反应生成H2和一种黑色固体。根据以上信息回答下列问题:
(1)写出化学式:A.________;B.________;C.________。
(2)写出化学方程式:
①A在空气中燃烧 _______________________________;
②C与水蒸气反应_________________________________________;
③A与水反应________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由1分子磷酸、1分子碱基和1分子化合物a构成了化合物b,如图所示,则下列叙述正确的是( )
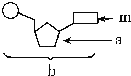
A. 若m为腺嘌呤,则b肯定为腺嘌呤脱氧核苷酸
B. 若a为核糖,b则为DNA的基本组成单位
C. 若m为尿嘧啶,则由b构成的大分子可被吡罗红染色
D. 在人和SARS病毒体内,化合物b都含有8种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学——选修3:物质结构与性质】
第四周期的过渡元素在工业、农业、科学技术以及人类生活等方面有重要作用。请回答:
(1)科学研究表明用TiO2作光催化剂可将废水中CN转化为OCN、并最终氧化为N2、CO2。OCN—中三种元素的第一电离能由大到小的顺序为。与OCN互为等电子体的一种分子为(填化学式)。
(2)Ti(BH4)2是一种储氢材料。写出基态Ti2+的电子排布式 , BH4中B原子的杂化轨道类型是。
(3)[Cr(H2O)4Cl2]Cl·2H2O中Cr的配位数为;
已知CrO5中Cr为+6价,则CrO5的结构式为。
(4)金属镍粉在CO气流中轻微加热,生成无色挥发性液态Ni(CO)4 , 该物质晶胞呈正四面体构型。试推测Ni(CO)4的晶体类型为 , Ni(CO)4易溶于下列(填选项字母)中。
A.水 B.四氯化碳 C.苯 D.硫酸镍溶液
(5)FeO、NiO晶体中r(Ni2+)和r(Fe2+)分别为69 pm和78 pm,则熔点NiO FeO(填“>”或“<”),原因为。
(6)硒化锌(SnSe)是一种重要的半导体材料,其晶胞结构如图所示,则该晶胞中硒原子的配位数为;若该晶胞密度为ρ g·cm3 , 硒化锌的摩尔质量为M g/mol。NA代表阿伏加德罗常数,则晶胞参数a为pm。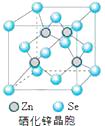
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 常温下SiO2与碳酸钠溶液反应生成CO2
B. 通过反应Na2SiO3+2HCl![]() 2NaCl+H2SiO3(胶体)制取硅酸是利用了可溶性酸制难溶性酸的性质
2NaCl+H2SiO3(胶体)制取硅酸是利用了可溶性酸制难溶性酸的性质
C. 因为硅酸难溶于水,所以它不能与NaOH溶液反应
D. 硅胶可用作袋装食品的干燥剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】自来水中因含有少量Fe3+ 而不能用于溶液的配制,实验室为了除去自来水中的Fe3+制取蒸馏水,可采用的方法是
A. 过滤法 B. 蒸馏法 C. 结晶法 D. 冰冻法
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com