
分别向1 L 0.5 mol·L-1的BaOH)2溶液中加入①浓硫酸、②稀硫酸、③稀硝酸,恰好完全反应时的热效应分别为ΔH1、ΔH2、ΔH3,下列关系中正确的是 )。
A.ΔH1>ΔH2>ΔH3 B.ΔH1<ΔH2<ΔH3
C.ΔH1>ΔH2=ΔH3 D.ΔH1=ΔH2<ΔH3
 黄冈冠军课课练系列答案
黄冈冠军课课练系列答案科目:高中化学 来源: 题型:
设NA表示阿伏加德罗常数的数值。下列说法正确的是
( )
A.1 L 0.1 mol·L-1 AlCl3溶液中Al3+的数目为0.1NA
B.常温常压下,17 g NH3中含有的原子总数为4NA
C.1 mol羟基中含有10NA个电子
D.常温常压下,2.24 L CH4中含有的碳原子总数为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
对于2SO2+O2⇌2SO3 ΔH<0的反应,下列说法中正确的是( )
A.当SO2和SO3的浓度相等时,反应达到化学平衡状态
B.当生成O2的速率与生成SO3的速率相等时,反应达到化学平衡状态
C.温度一定,若SO2、O2、SO3的起始浓度不同,反应达到平衡时,SO3的平衡浓度有可能相同
D.只有当外界条件改变,使v正>v逆,才能引起上述化学反应的平衡发生移动
查看答案和解析>>
科目:高中化学 来源: 题型:
在一体积可变的密闭容器中,加入一定量的X、Y,发生反应mX(g) 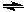 nY(g)ΔH=Q kJ·mol-1。反应达到平衡时,Y的物质的量浓度与温度、气体体积的关系如下表所示,下列说法正确的是( )
nY(g)ΔH=Q kJ·mol-1。反应达到平衡时,Y的物质的量浓度与温度、气体体积的关系如下表所示,下列说法正确的是( )
A.m>n B.体积不变,温度升高,平衡向逆反应方向移动
C.Q<0 D.温度不变,压强增大,Y的质量分数减少
查看答案和解析>>
科目:高中化学 来源: 题型:
25 ℃时,下列说法正确的是双选) )。
A.pH=12的NaOH溶液中,cH+)=10-12 mol·L-1,将溶液稀释为原体积的10倍后cH+)=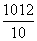 mol·L-1=10-13mol·L-1
mol·L-1=10-13mol·L-1
B.pH=3的CH3COOH溶液与pH=11的NaOH溶液等体积混合后,因生成的CH3COONa
水解,所以由水电离出的cH+)<10-7mol·L-1
C.pH=2的盐酸、pH=2的醋酸中由水电离出的cH+)均为10-12 mol·L-1
D.pH=11和pH=13的NaOH溶液等体积混合后,溶液中的cH+)=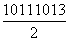 mol·L-1
mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
1)25 ℃、101 kPa时,1 g甲醇完全燃烧生成CO2和液态水,放出22.68 kJ热量,则该反应的热化学方程式为____________________________________________________。
2)0.3 mol气态高能燃料乙硼烷B2H6)在O2中燃烧,生成固态B2O3和液态水,放出649.5 kJ热量,则该反应的热化学方程式为____________________________________________________。
3)肼N2H4)是一种高效清洁的火箭燃料。
0.25 mol N2H4g)完全燃烧生成氮气和气态水时,放出133.5 kJ热量,则肼燃烧的热化学方程式为_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
一定温度下,在三个体积均为1.0 L 的恒容密闭容器中发生反应:
2CH3OHg)CH3OCH3g)+H2Og)
| 容器 编号 | 温度℃) | 起始物质的量mol) | 平衡物质的量mol) | |
| CH3OHg) | CH3OCH3g) | H2Og) | ||
| Ⅰ | 387 | 0.20 | 0.080 | 0.080 |
| Ⅱ | 387 | 0.40 | ||
| Ⅲ | 207 | 0.20 | 0.090 | 0.090 |
下列说法正确的是双选) )。
A.该反应的正反应为放热反应
B.达到平衡时,容器Ⅰ中的CH3OH体积分数比容器Ⅱ中的小
C.容器Ⅰ中反应达到平衡所需时间比容器Ⅲ中的长
D.若起始时向容器Ⅰ中充入CH3OH 0.15 mol、CH3OCH3 0.15 mol和H2O 0.10 mol,则反应将向正反应方向进行
查看答案和解析>>
科目:高中化学 来源: 题型:
氮氧化物能造成光化学烟雾,引起大气污染,用以下方法可以消除。
Ⅰ.活性炭还原法处理氮氧化物。若向2L密闭容器加入一定量的活性炭和NO,恒温(T1℃)条件下反应生成甲和乙,甲和乙均为参与大气循环的物质,反应进行到不同时间测得各物质的物质的量浓度如下:
|
| NO | 甲 | 乙 |
| 0 | 0.100 | 0 | 0 |
| 10 | 0.058 | 0.021 | 0.021 |
| 20 | 0.040 | 0.030 | 0.030 |
| 30 | 0.040 | 0.030 | 0.030 |
| 40 | 0.032 | 0.034 | 0.017 |
| 50 | 0.032 | 0.034 | 0.017 |
(1)该反应的化学方程式为_____________________________________________
(2)T1℃时,该反应的平衡常数K=______________
(3) 30min时改变的的条件是_______________。若30min后升高温度至T2,达到平衡时,容器中NO、甲、乙的浓度之比为2∶1∶1,则反应的△H__________0(填“<”、“=”、“>”)。
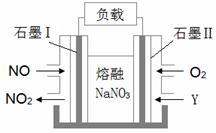 Ⅱ.以NO、O2、熔融NaNO3组成的燃料电池装置如图所示,在使用过程中石墨电极Ⅰ生成NO2。
Ⅱ.以NO、O2、熔融NaNO3组成的燃料电池装置如图所示,在使用过程中石墨电极Ⅰ生成NO2。
(4)石墨电极Ⅰ的反应式为______________________;为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定,即必须在石墨电极Ⅱ电极处通入一种氧化物Y,Y是_______________(填物质的化学式)。
Ⅲ.CH4催化还原法。已知:
①CH4(g)+4NO2(g)  4NO(g)+CO2(g)+2H2O(l) △H=-622kJ/mol
4NO(g)+CO2(g)+2H2O(l) △H=-622kJ/mol
②CH4(g)+2NO2(g)  N2(g)+CO2(g)+2H2O(l) △H=-955kJ/mol
N2(g)+CO2(g)+2H2O(l) △H=-955kJ/mol
③H2O(g)=H2O(l) △H=-44.0kJ/mol
(5)写出CH4(g)与NO(g)反应生成N2(g)、CO2(g)和H2O(g)的热化学方程式______________________________________________________________。
(6)假设在某温度下反应①的速率(v1)大于反应②的速率(v2)则下列反应过程能量变化示意图正确的是________(填写正确选项的字母)。
|
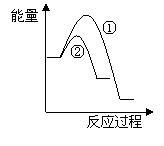
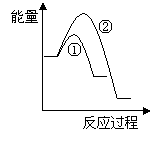
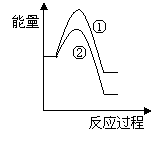
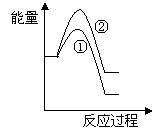


(7)恒温恒容条件下,假设反应①和②同时发生,且v1>v2,请在下图中画出反应体系中c(NO)随时间t变化的总趋势图。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知元素X的电负性数值为2.5,元素Y的电负性数值是3.5,元素Z的电负性数值为1.2,元素W的电负性数值为2.4。你认为上述四种元素中,哪两种最容易形成离子化合物
A.X与Y B.X与W C.Y与Z D.Y与W
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com