
【题目】结晶硫酸亚铁部分失水时,分析结果如仍按FeSO4·7H2O的质量分数计算,其值会超过100%。国家标准规定,FeSO4·7H2O的含量:一级品99.50%~100.5%;二级品99.00%~100.5%;三级品98.00%~101.0%。
为测定样品中FeSO4·7H2O的质量分数,可采用在酸性条件下与高锰酸钾溶液进行滴定。
5Fe2++MnO4-+8H+→5Fe3++Mn2++4H2O;
2MnO4-+5C2O42-+16H+→2Mn2++10CO2↑+8H2O
测定过程:粗配一定浓度的高锰酸钾溶液1L,然后称取0.200 g 固体Na2C2O4(式量为134.0)放入锥形瓶中,用蒸馏水溶解并加稀硫酸酸化,加热至70℃~80℃。
(1)若要用滴定法测定所配的高锰酸钾溶液浓度,滴定终点的现象是_______________。
(2)将溶液加热的目的是____;反应刚开始时反应速率较小,其后因非温度因素影响而增大,根据影响化学反应速率的条件分析,其原因可能是______________________。
(3)若滴定时发现滴定管尖嘴部分有气泡,滴定结束气泡消失,则测得高锰酸钾浓度_____(填“偏大”“偏小”“无影响”)。
(4)滴定用去高锰酸钾溶液29.50mL,则c(KMnO4)=_____mol/L(保留四位有效数字)。
(5)称取四份FeSO4·7H2O试样,质量均为0.506g,,用上述高锰酸钾溶液滴定达到终点,记录滴定数据
滴定次数 实验数据 | 1 | 2 | 3 | 4 |
V(高锰酸钾)/mL(初读数) | 0.10 | 0.20 | 0.00 | 0.20 |
V(高锰酸钾)/mL(终读数) | 17.76 | 17.88 | 18.16 | 17.90 |
该试样中FeSO4·7H2O的含量(质量分数)为_________(小数点后保留两位),符合国家______级标准。
(6)如实际准确值为99.80%,实验绝对误差=____%,如操作中并无试剂、读数与终点判断的失误,则引起误差的可能原因是:__________。
【答案】滴入最后1滴KMnO4溶液后,溶液变为浅红色,且半分钟不褪去 加快反应速率 反应开始后生成Mn2+,而Mn2+是上述反应的催化剂,因此反应速率加快 偏小 0.02024 98.30% 三 -1.5% 空气中氧气氧化了亚铁离子使高锰酸钾用量偏小
【解析】
(1)依据滴定实验过程和试剂滴入顺序可知,滴入高锰酸钾溶液最后一滴,溶液变红色,半分钟内不变证明反应达到终点;
故答案为:滴入最后1滴KMnO4溶液后,溶液变为浅红色,且半分钟不褪去;
(2)加热加快反应速率,反应过程中生成的锰离子对反应有催化作用分析;
(3)若滴定时发现滴定管尖嘴部分有气泡,滴定结束气泡消失,消耗高锰酸钾待测溶液体积增大,则测得高锰酸钾浓度减小;
(4)2MnO4-+5C2O42-+16H+→2Mn2++10CO2↑+8H2O,依据化学反应定量关系,计算所标定高锰酸钾溶液的浓度;
(5)依据图表数据计算,第三次实验数据相差大舍去,计算其他三次的平均值,利用反应定量关系计算亚铁离子物质的量得到FeSO4·7H2O的含量,结合题干信息判断符合的标准;
(6)测定含量-实际含量得到实验绝对误差,亚铁离子溶液中易被空气中氧气氧化分析可能的误差。
(1)依据滴定实验过程和试剂滴入顺序可知,滴入高锰酸钾溶液最后一滴,溶液变红色,半分钟内不变证明反应达到终点;
(2)粗配一定浓度的高锰酸钾溶液1L,然后称取0.200g 固体Na2C2O4(式量为134.0)放入锥形瓶中,用蒸馏水溶解并加稀硫酸酸化,加热至70℃~80℃,加热加快反应速率,反应刚开始时反应速率较小,其后因非温度因素影响而增大,根据影响化学反应速率的条件分析,其原因可能是反应过程中生成的锰离子对反应有催化作用分析;
故答案为:加快反应速率,反应开始后生成Mn2+,而Mn2+是上述反应的催化剂,因此反应速率加快;
(3)若滴定时发现滴定管尖嘴部分有气泡,滴定结束气泡消失,消耗高锰酸钾待测溶液体积增大,溶质不变则测得高锰酸钾浓度减小;
故答案为:偏小;
(4)0.200g 固体Na2C2O4(式量为134.0),n(C2O42-)=![]() =0.0014925mol,依据化学反应定量关系,计算所标定高锰酸钾溶液的浓度;
=0.0014925mol,依据化学反应定量关系,计算所标定高锰酸钾溶液的浓度;
2MnO4-+5C2O42-+16H+→2Mn2++10CO2↑+8H2O,
2 5
n 0.0014925mol
n=0.000597mol
滴定用去高锰酸钾溶液29.50mL,
则c(KMnO4)=![]() =0.02024mol/L;
=0.02024mol/L;
(5)依据图表数据计算,第三次实验数据相差大舍去,
计算其他三次的平均值=![]() =17.68mL,利用反应定量关系计算亚铁离子物质的量得到FeSO4·7H2O的含量,
=17.68mL,利用反应定量关系计算亚铁离子物质的量得到FeSO4·7H2O的含量,
5Fe2++MnO4-+8H+→5Fe3++Mn2++4H2O;
5 1
n 0.01768L×0.02024mol/L
n=0.001789mol
FeSO4·7H2O的含量=![]() ×100%=98.30%,三级品98.00%~101.0%
×100%=98.30%,三级品98.00%~101.0%
结合题干信息判断符合的标准三级品;
(6)测定含量-实际含量得到实验绝对误差=98.30%-99.80%=-1.5%,亚铁离子溶液中易被空气中氧气氧化为铁离子,高锰酸钾溶液用量减小引起误差。


科目:高中化学 来源: 题型:
【题目】已知化学反应2C(s)+O2(g)![]() 2CO(g);2CO(g)+O2(g)
2CO(g);2CO(g)+O2(g)![]() 2CO2(g)都是放热反应。据此推断在相同条件下,下列说法不正确的是( )
2CO2(g)都是放热反应。据此推断在相同条件下,下列说法不正确的是( )
A.56 g CO和32 g O2所具有的总能量之和大于88 g CO2所具有的总能量
B.12 g C所具有的能量一定高于28 g CO所具有的能量
C.12 g C和32 g O2所具有的总能量大于44 g CO2所具有的总能量
D.将两份质量相等的碳完全燃烧,生成CO2的反应比生成CO的反应放出的热量多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列水解反应的离子方程式书写正确的是
A.Fe3++3H2O![]() Fe(OH)3↓+3H+
Fe(OH)3↓+3H+
B.Cl+H2O![]() HCl+OH
HCl+OH
C.CO32-+2H2O![]() H2CO3+2OH
H2CO3+2OH
D.NH4++2H2O![]() NH3·H2O+H3O+
NH3·H2O+H3O+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是
A.氯化铝溶液与一定量的碳酸钠溶液反应:Al3++3CO32-+3H2O=Al(OH)3↓+3HCO3-
B.氯化钠固体与浓硫酸混合微热:Cl-+H+![]() HCl↑
HCl↑
C.氯气通入石灰乳:Cl2+2OH-=Cl-+ClO-+H2O
D.苯酚钠溶液呈碱性的原理:C6H5O-+H2O→C6H5OH+OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对氧化还原反应:11P+15CuSO4+24H2O→5Cu3P+6H3PO4+15H2SO4,下列说法正确的是
A.5/11的磷被氧化
B.3mol CuSO4可氧化11/5mol P
C.每摩尔起氧化作用的磷能氧化磷生成磷酸的物质的量为0.6mol
D.当1mol P参加反应时,转移电子的物质的量为3 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯气可直接用于自来水的消毒,也可以制取漂粉精、高铁酸钠等物质来对自来水消毒。
(1)氯气通入水中可用来杀菌消毒,其中杀菌消毒的原理是___,其有效成分的电子式是____。
(2)氯气可用来制取漂粉精,但干燥的氢氧化钙与氯气并不易发生反应,氯气只能被氢氧化钙所吸附。为此,在工业上采用加入少许水的消石灰来进行氯化。其原因是____;
(3)漂粉精的消毒能力受水的pH影响,pH较小时的消毒能力____(填“大于”或“小于”) ;pH大时的消毒能力,其原因是______。
(4)用氯气对饮用水消毒副作用多,产生影响人体健康有机氯衍生物。可用氯气制取高铁酸钠净水:___Fe3++____ (__________) + ___Cl2→___FeO42-+____ +___H2O
补全缺项,并配平上述离子方程式;
(5)计算Na2FeO4的消毒效率(以单位质量得到的电子数表示)约是氯气____倍。说明该净水剂与氯气相比较有何优越性 _______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化学用语表示正确的是
①CSO的电子式:![]()
②对硝基苯酚的结构简式:![]()
③Cl-的结构示意图: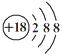
④苯分子的比例模型:
⑤葡萄糖的实验式:CH2O
⑥原子核内有20个中子的氯原子:![]()
⑦HCO3-的水解方程式为:HCO3-+H2O![]() CO32-+H3O+
CO32-+H3O+
A.①④⑤B.①②③④⑤C.③⑤⑥⑦D.全部正确
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A(C6H8O4)为食品包装纸的常用防腐剂。A可以使溴水褪色。A难溶于水,但在酸性条件下可发生水解反应,得到B(C4H4O4)和甲醇。通常状况下B为无色晶体,能与氢氧化钠溶液发生反应。
(1)A可以发生的反应有_______________(选填序号)。
①加成反应 ②酯化反应 ③加聚反应 ④氧化反应
(2)B分子所含官能团的名称是______________________________。
(3)B分子中没有支链,其结构简式是________________________,B的具有相同官能团的同分异构体的结构简式是_________________。
(4)由B制取A的化学方程式是____________________________________。
(5)天门冬氨酸(C4H7NO4)是组成人体蛋白质的氨基酸之一,可由B通过以下反应制取:
![]()
天门冬氨酸的结构简式是______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有氢气与氯气的混合气体0.1mol,经充分反应后,通入60mL 2mol/L的NaOH溶液中,所得溶液中只含有2种溶质,其中NaCl为0.1mol。则原混合气体中氢气的物质的量可能是( )
A.0.03molB.0.04molC.0.05molD.0.06mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com