
| A. | ①②④ | B. | ①④⑥ | C. | ②③⑥ | D. | ③⑤⑥ |
分析 化学反应COCl2(g)?CO(g)+Cl2(g)△H>0;是气体体积增大的反应,正向反应是吸热反应;转化率的变化根据化学平衡的移动方向分析判断.
①升温平衡向吸热反应方向移动;
②恒容通入惰性气体,各组分的浓度不变,反应速率不变;
③增加CO的浓度,平衡逆向进行;
④扩大容器体积相当于减小压强,减压平衡向气体体积增大的方向进行,平衡正向进行;
⑤加催化剂,改变速率不改变平衡;
⑥恒压通入惰性气体,体积增大,相当于减小压强.
解答 解:化学反应COCl2(g)?CO(g)+Cl2(g)△H>0;是气体体积增大的反应,正向反应是吸热反应;
①升温平衡向吸热反应方向移动;平衡正向进行,COCl2转化率增大,故①符合;
②恒容通入惰性气体,各组分的浓度不变,正逆反应速率不变,平衡不移动,故②不符合;
③增加CO的浓度,平衡逆向进行;COCl2转化率减小,故③不符合;
④减压平衡向气体体积增大的方向进行,平衡正向进行;COCl2转化率增大,故④符合;
⑤加催化剂,改变速率不改变平衡;COCl2转化率不变,故⑤不符合;
⑥恒压通入惰性气体,体积增大,相当于减小压强,平衡正向进行;COCl2转化率增大,故⑥符合;
综上所述:①④⑥正确,
故选B.
点评 本题考查了化学平衡的影响因素的分析判断,体积改变,平衡移动方向是判断的关键,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | Ba(OH)2 和盐酸;Ba(OH)2和 H2SO4 | |
| B. | BaCl2和Na2SO4;Ba(OH)2和(NH4)2SO4 | |
| C. | Ca(OH)2溶液通过量CO2; NaOH溶液通过量CO2 | |
| D. | Ba(OH)2和 HNO3; Cu (OH)2和 H2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2N2H4(g)+2NO2(g)═3N2(g)+4H2O(l);△H=-1135.7 kJ/mol | |
| B. | 2N2H4(g)+2NO2(g)═3N2(g)+4H2O(g);△H=-1000.3 kJ/mol | |
| C. | N2H4(g)+NO2(g)═N2(g)+2H2O(l);△H=-1135.7 kJ/mol | |
| D. | 2N2H4(g)+2NO2(g)═3N2(g)+4H2O(g);△H=-1135.7 kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
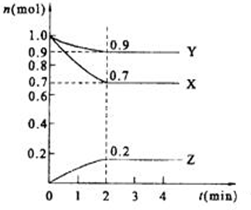 某温度时,在2L的密闭容器中,X、Y、Z(均为气体)三种物质的量随时间的变化曲线如图所示.
某温度时,在2L的密闭容器中,X、Y、Z(均为气体)三种物质的量随时间的变化曲线如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 6 | B. | 3 | C. | 1 | D. | 0.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将铜丝弯成螺旋状,在酒精灯上加热变黑后,立即伸入盛有无水乙醇的试管中,反复多次,完成乙醇氧化为乙醛的实验 | |
| B. | 实验室制取乙炔时,用饱和食盐水代替蒸馏水,以得到平稳的气流 | |
| C. | 向试管中先加入无水乙醇,再加入适量冰醋酸与一定量浓硫配制的混酸,然后加热制取乙酸乙酯 | |
| D. | 验证蔗糖水解产物时,将反应后的溶液与银氨溶液混合水浴加热,观察现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
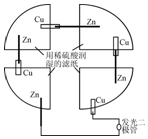 将一张滤纸剪成四等份,用铜片、锌片、发光二极管、导线在玻璃片上连接成如图所示的装置,在四张滤纸上滴入稀H2SO4直至全部润湿.下列叙述正确的是( )
将一张滤纸剪成四等份,用铜片、锌片、发光二极管、导线在玻璃片上连接成如图所示的装置,在四张滤纸上滴入稀H2SO4直至全部润湿.下列叙述正确的是( )| A. | 锌片上有气泡,铜片溶解 | B. | 电子都是从铜片经外电路流向锌片 | ||
| C. | Zn片发生还原反应 | D. | 该装置至少有两种形式的能量转换 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com