
| A. | 呈酸性 | B. | c(H+)=1×10-6mol/L | ||
| C. | c(OH-)=1×10-6mol/L | D. | 无法判断 |
 科学实验活动册系列答案
科学实验活动册系列答案科目:高中化学 来源: 题型:填空题
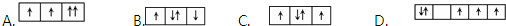
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
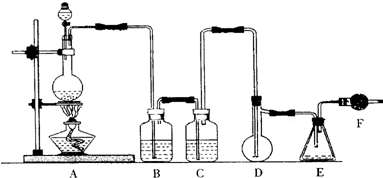
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
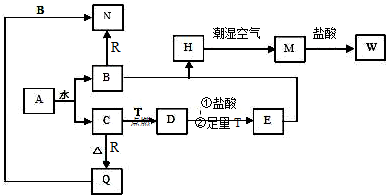
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | XCl | B. | XCl2 | C. | XCl3 | D. | XCl4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | A | |||||||
| 2 | B | C | D | E | ||||
| 3 | F | G | H | I | L |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向饱和碳酸氢钙溶液中加入过量的NaOH溶液:Ca2++HCO3-+OH-=CaCO3↓+H2O | |
| B. | KAl(SO4)2中滴加Ba(OH)2使SO42-恰好完全沉淀:2Al3++3SO42-+3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓ | |
| C. | 氢氧化钠溶液吸收少量SO2气体:SO2+2OH-=SO32-+H2O | |
| D. | 硫酸亚铁加过氧化氢溶液:Fe2++H2O2+2H+=Fe3++2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
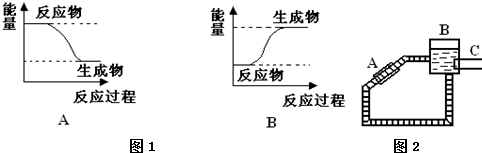
| 盐 | 熔点/℃ | 熔化吸热/KJ•mol-1 | 参考价格/元•kg-1 |
| CaCl2•6H2O | 29.0 | 37.3 | 780~850 |
| Na2SO4•10H2O | 32.4 | 77.0 | 800~900 |
| Na2HPO4•12H2O | 36.1 | 100.1 | 1600~2000 |
| Na2S2O3•5H2O | 48.5 | 49.7 | 1400~1800 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com